Post-Covid Syndroom (PCS), Complex en Delicaat
(bijgewerkt januari 2025)
Inleiding
Sinds de uitbraak van het SARS-CoV-2 virus in 2020 kampen veel patiënten met een veelheid aan klachten. De ernst van deze klachten leidt in veel gevallen tot beperkingen in het dagelijkse functioneren tot zelfs invaliditeit en blijvende uitval uit het arbeidsproces.
Prevalentie
Hoeveel patiënten er nu werkelijk in Nederland zijn is afhankelijk van aan wie je het vraagt. Volgens het ministerie van VWS zijn het 1% van 240.000, dus 2.400 mensen met PCS-gerelateerde klachten, volgens PostCovid.NL gaat het om 80.000-127.000 patiënten, het RIVM noemt slecht procenten en geen aantallen, C-Support heeft het over 90.000 patiënten met ernstige, beperkende klachten. UMC Utrecht stelt dat het in Nederland om honderduizenden patiënten gaat, bij monde van prof. dr. Marc Bonten en prof. dr. Janneke van de Wijgert [1]
Feit is dat er geen betrouwbare cijfers zijn, enerzijds omdat de overheid het probleem lange tijd niet serieus nam, anderzijds omdat veel meldingen stranden bij huisartsen. Wel lijkt langzaam ook bij de overheid het besef door te dringen dat we (al 5 jaar) te maken hebben met een “stille” pandemie die sinds de COVID-pandemie, nog steeds voortwoekert.
De WHO telde in 2020 4.1 miljoen en in 2021 8,8 miljoen COVID doden wereldwijd, waardoor COVID-19 na Ischemische Cardiale Aandoeningen, de hoogste doodsoorzaak werd. Cijfers over 2023 en 2024 werden niet genoemd [2]. Ook werden geen cijfers gepubliceerd over het aantal Post-Covid patiënten. Dit wordt mede veroorzaakt doordat er (vreemd genoeg) nog steeds geen consensus is over de definitie, symptomatiek en diagnostiek van PCS.
Oorzaak en gevolg
Sinds de uitbraak in 2020 zijn er tot op heden al meer dan 451.000 wetenschappelijke onderzoeken naar COVID-19 uitgevoerd (bron: PubMed). Noot: het is op z’n zachts gezegd verwonderlijk dat er in Nederland per 01-11-2024 (!) expertisecentra werden opgezet om kennis te verzamelen.
Over de langdurige gevolgen van SARS-CoV-2 is inmiddels internationaal veel bekend. De lijst met klachten is bijzonder lang:
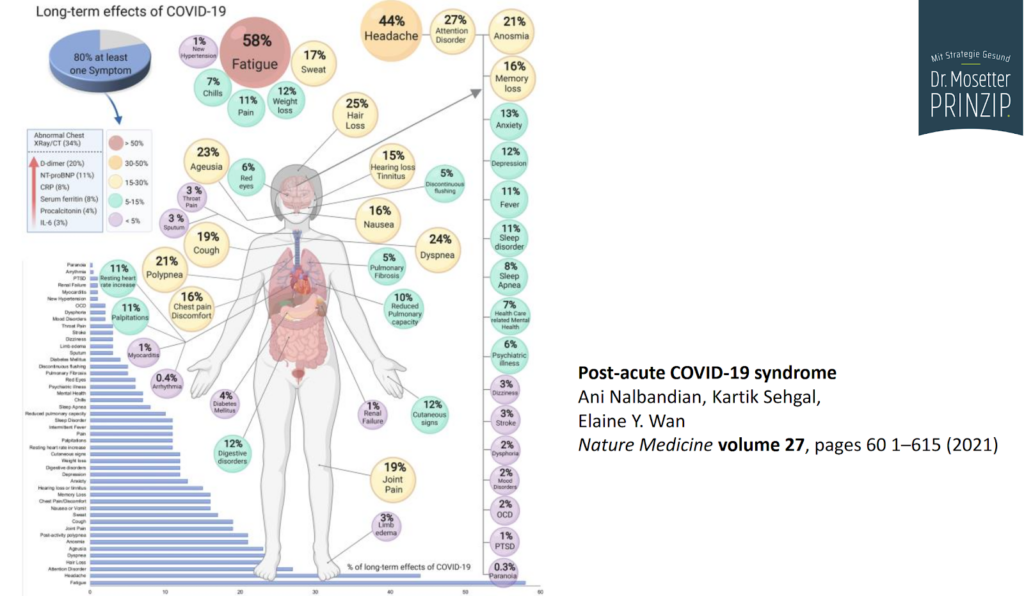
Veel patiënten met Post-Covid worden ten onrechte behandeld met antidepressiva. ME/CVS (Myalgische Encefalomyelitis/Chronisch Vermoeidheids Syndroom), Lyme, Herpes of Pfeifer zijn feitelijk dezelfde aandoeningen. Vergelijkbare symptomen werden gemeld bij het Middle East Respiratory Syndrome (MERS)
en posttraumatische stressstoornis [3, 4, 5, 6]. Oorzakelijk ligt er een infectie met een bacterie of virus (zoals Epstein-Barr-Virus, Herpes virussen, Influenza, Borrelia, Enterovirussen en intracellulaire bacteriën) aan ten grondslag. Hierbij worden de mitochondriën beschadigd met als gevolg een scala aan symptomen die identiek zijn [7]. Hierbij dient wel opgemerkt te worden dat een besmetting in de meeste gevallen na een periode van (milde) verschijnselen spontaan herstelt.
De differentiatie van depressie, ME/CVS en PCS, burn-out, MCAS is bijzonder belangrijk omdat het veel invloed heeft op welke behandeling van toepassing is. Zoals verderop in dit artikel wordt uitgelegd, zijn er ook in de onderzoeken wezenlijke verschillen te vinden. Alle genoemde aandoeningen verdienen de juiste diagnostiek en de daarop toegespitste behandeling.
Vanwege de symptomatische overeenkomsten tussen de wezenlijk verschillende aandoeningen is er de samenwerkingsalliantie PAIS (Post Acuut Infectieus Syndroom) die kennis hierover bundelt.
Vooral in het oog springende klachten als PEM (Post Exertional Malaise) waarbij na inspanning een extreme vermoeidheid optreedt die soms uren tot dagen kan aanhouden, worden ook gezien bij ME/CVS of burn-out.
POTS (Postural Orthostatic Tachycardia Syndrom) waarbij PCS-patiënten bij opstaan een extreme verhoging van de hartslag ervaren waardoor het gevoel van duizeligheid ontstaat wordt nogal eens verward met MCAS (Mast Cell Activication Syndrome) of orthostatische hypotensie. In de differentiaal diagostiek zijn er aantoonbare verschillen.
Angststoornissen en dysautonomie zijn specifieke symptomen die bij het hele scala van PCS-klachten hoort. Dysautonomie is een ontregeling van het autonoom zenuwstelsel. Het ANS (Autonom Nerve System) bestaat uit de sympaticus en de parasympaticus. Door middel van de meting van de Heart Rate Variability (HRV) is objectief te meten hoe het autonoom zenuwstelsel reageert op de dagelijkse activiteiten.
Een PCS-patiënt met antidepressiva behandelen is het paard achter de wagen spannen!
(Met dank voor de aanvulling door Gz psycholoog Beatrice Khouri)
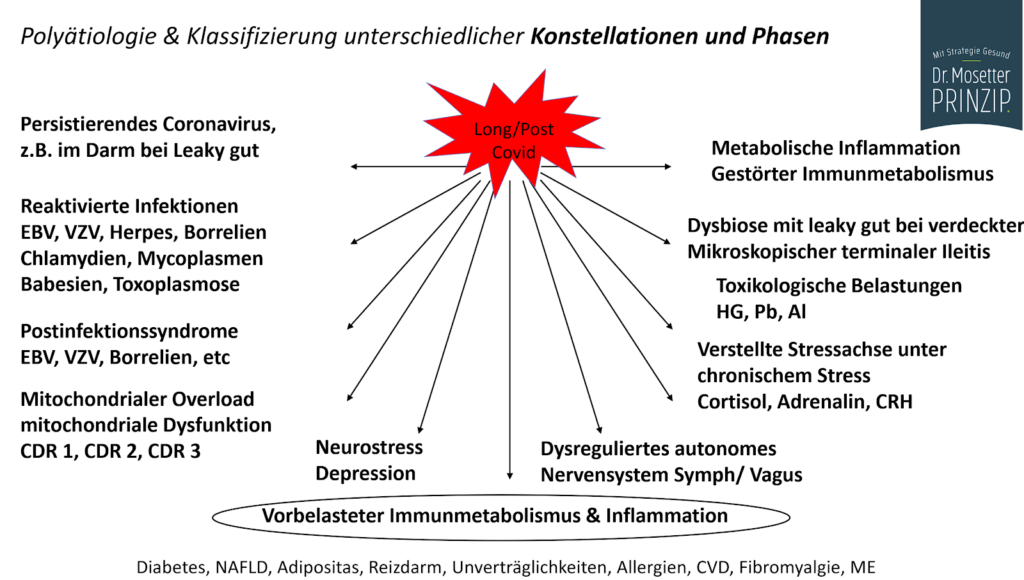
Ook de meeste oorzaken van de klachten zijn inmiddels goed in kaart gebracht.
Huidige behandelingen van PCS
In Nederland zijn er de afgelopen jaren diverse therapieën opgezet. Deze variëren van psychotherapie, fysiotherapie, EMDR, revalidatie, immunotherapie, ergotherapie, voetzoolreflexie, hyperbare zuurstof, ozontherapie en een heel scala aan diëten. Post-Covid patiënten worden hierbij begeleid door een leger aan (zelfbenoemde) therapeuten. Vaak gemotiveerd om mensen te helpen, soms helaas ook vanuit een financiële drijfveer.
Post-Covid patiënten hebben weinig energie. Het verbeteren van conditie en uithoudingsvermogen door fitnesstraining heeft een tegenovergesteld effect. Patiënten raken hierdoor steeds vermoeider en de PEM ( Post Exertional Malaise, uitputting na inspanning) verergert.
Ook zien we dat veel patiënten ten onrechte worden gediagnosticeerd als depressief of burnout. Het toepassen van antidepressiva verergert de klachten vanwege de bijwerking als sufheid, duizeligheid, vermoeidheid en soms spraakstoornissen. Symptomen die PCS-patiënten al hebben.
Op 1 november 2024 zijn de eerste post-COVID expertisecentra in Nederland geopend. Deze centra zijn opgericht met een dubbele missie: het bieden van hoogwaardige zorg en het versneld opdoen van kennis en ervaring. De centra zijn opgericht om snel kennis en ervaring op te doen en deze vervolgens te delen. De behandelingen zijn vooralsnog niet genezend maar symptoom bestrijdend. [8].
Behandelingen kunnen bestaan uit een dieet, medicatie (off label) of steunkousen. Een uiterst mager antwoord op de complexiteit en de impact van Post-Covid.
Het post-COVID-syndroom wordt geassocieerd met de betrokkenheid van verschillende organen en systemen, zoals long, lever, nier, hart, maag-darmstelsel, hematologisch stelsel en zenuwstelsel met een hoog sterftecijfer en inductie van multi-orgaanfalen.
In Nederland ontbreekt het vooralsnog aan een causale behandeling van Post-Covid.
Onderzoeken en bepalingen:
Over de etiologie van Post-Covid komt internationaal steeds meer concensus. Er zijn veel pathofysiologische paden bij PCS betrokken, waaronder virale persistentie, een chronische, laaggradige ontstekingsreactie, immuundisregulatie en een gebrekkige immuunrespons; de reactivering van latente virussen; auto-immuniteit; aanhoudende
endotheeldisfunctie en coagulopathie; darmdysbiose; hormonale en metabolische disregulatie; mitochondriale disfunctie en autonome zenuwstelsel disfunctie. [9]
Er zijn geen specifieke tests voor de diagnose PCS en klinische kenmerken, waaronder laboratoriumuitslagen en biomarkers, kunnen niet specifiek in verband worden gebracht met PCS. Daarom is het van het grootste belang om biomarkers te ontwikkelen en te valideren die gebruikt kunnen worden voor de voorspelling, diagnose en prognose van PCS en de therapeutische respons.
Zoals gezegd, is dit lastig vanwege de niet-specifieke aard van de meeste klinische verschijnselen in het PCS-spectrum. Veelbelovende biomarkers die bij sommige patiënten worden gevonden, zijn markers van systemische ontsteking, waaronder acute-fase-eiwitten, cytokinen en chemokinen; biomarkers die de persistentie van SARS-CoV-2, de reactivatie van herpesvirussen en immuundisregulatie weergeven; biomarkers van endotheliopathie, stolling en fibrinolyse; veranderingen in de microbiota; diverse eiwitten en metabolieten; hormonale en metabolische biomarkers; en cerebrospinale vloeistof biomarkers.
Ontstekingsmarkers
Als reactie op een virale infectie in de acute fase, activeert het immuunsysteem verschillende cellen (T-cellen, macrofagen, enz.), waarbij verschillende ontstekingsmoleculen vrijkomen, waaronder cytokinen en chemokinen. SARS-CoV-2-infectie kan een “cytokinestorm” uitlokken die gekenmerkt wordt door een gematigde proinflammatie (afgifte van ontstekingsbevorderende cytokinen), geassocieerd met ernstige ontregeling van monocyten.
Acute Respiratory Distress Syndrome (ARDS), een levensbedreigende plotselinge ontstekingsreactie in de longen waarbij zich vocht ophoopt in de longen, dat zuurstofopname bemoeilijkt, is een van de belangrijkste doodsoorzaken bij patiënten met COVID-19 en wordt voornamelijk veroorzaakt door de cytokinestorm [10].
Een zeer recente meta-analyse van 23 onderzoeken met 18 meta-geanalyseerde biomarkers vond dat patiënten hersteld van PCS, hogere niveaus van CRP, D-dimeer, lactaatdehydrogenase (LDH) en leukocyten vertoonden dan controles zonder PCS.
Na gevoeligheidsanalyses waren lymfocyten en IL-6 ook significant verhoogd in gevallen met PCS. Met name verschillen in de niveaus van D-dimeer, LDH en lymfocyten waren prominent in de groep patiënten met orgaanafwijkingen, terwijl verschillen in de niveaus van IL-6 werden waargenomen in de groep patiënten met aanhoudende symptomen. Bovendien werden verschillen in de niveaus van LDH, leukocyten en N-terminal pro b-type natriuretisch peptide (NT-Pro-BNP) gevonden in de groep patiënten met symptomen van minder dan 6 maanden. Terwijl verschillen in D-dimeerwaarden werden gevonden bij patiënten met symptomen van meer dan
6 maanden. IL-8, een chemokine die neutrofielen activeert op de plaats van de ontsteking, bleek verhoogd bij PCS-patiënten in vergelijking met gezonde mensen.
Tot slot bleek uit een andere meta-analyse van 22 case-control observationele onderzoeken dat IL-6 hoger was bij patiënten met PCS in vergelijking met gezonde mensen zonder Post-Covid, maar lager dan bij patiënten tijdens de acute fase van
COVID-19.
Interleukin-6 (IL-6) is een praktische biomarker van systemische ontstekingen en nadelige uitkomsten bij acute COVID-19, kunnen dienen als een nuttige voorspeller van PCS van 4 weken na infectie. In verschillende onderzoeken, werden hogere niveaus van IL-6 tot 7 maanden aangetroffen bij patiënten met PCS.
Ook CRP, het acute fase-eiwit wordt verhoogd na het vrijkomen van IL-6 door macrofagen en T-cellen en is blijvend verhoogd bij PCS-patiënten vanaf de vroege fase tot 7 maanden daarna.
Aanvullende onderzoeken naar cytokinen en chemokinen tonen een toename aan van
IL-2 (dat de groei van helper-, cytotoxische en regulatoire T-cellen stimuleert), IL-17 (dat geassocieerd wordt met ontsteking en auto-immuunziekte), interferon (IFN)-γ (dat cruciaal is voor aangeboren en adaptieve immuniteit tegen virale infecties), CCL3 en CCL5 in de vroege fase van PCS. Patiënten met PCS en cognitieve symptomen vertoonden een verhoogd CCL11, dat in verband wordt gebracht met de remming van neurogenese, veroudering en cognitieve functie, vergeleken met patiënten met PCS maar zonder cognitieve symptomen.
Vergeleken met herstelde patiënten bleef IFN-γ verhoogd na 2 maanden, tumornecrosefactor-α (TNF-α) na 4 maanden en IFN-β en IFN-λ1 na 11 maanden bij PCS-patiënten. Interessant is dat het genotype AA van het IFNG-gen vaker voor bij PCS-patiënten. Andere acute fase eiwitten die reageren op proinflammatoire cytokinen en stijgen na ontsteking en weefselbeschadiging, zoals serum amyloïd 1 (SAA1) en SAA4, waren verhoogd in de microklonters van patiënten met PCS na 3 maanden.
In het algemeen worden bepaalde fenotypes van PCS geassocieerd met verhoogde biomarkers van systemische ontsteking. Deze biomarkers kunnen een voorspellende waarde hebben om patiënten met een risico op PCS op te sporen, maar ook een diagnostische waarde voor bepaalde fenotypen van PCS.
Immunologische markers
Onderzoeken naar immuundisregulatie bij patiënten met PCS hebben een overvloed aan veranderingen in immuuncellen gevonden. Verhoogde ontstekingsmonocyten (CD14+, CD16+, CCR5+) werden gevonden in gevallen vóór de ontwikkeling van PCS en in de herstellende chronische periode, samen met verhoogde niet-klassieke monocyten, die ook worden geassocieerd met verschillende chronische ontstekings- en auto-immuunziekten. Onderzoeken hebben ook verhoogde natural killer (NK) cellen aangetoond die markers van geheugen en activatie uitdrukken, hogere plasmacytoïde dendritische cellen met CD86- en CD38-markers, die een belangrijke rol spelen in antivirale immuniteit en betrokken zijn bij het ontstaan en de ontwikkeling van veel auto-immuunziekten, ontstekingsziekten, en dalingen in de aantallen conventionele dendritische cellen. [36]
Interessant genoeg vertonen patiënten met PCS, B- en T-celafwijkingen die ten minste een jaar aanhouden, waaronder verminderde naïeve B en T cellen; toegenomen B cellen en dubbel negatieve B-cellen, die zich uitbreiden bij oudere mensen maar zich ook vroegtijdig ophopen bij auto-immuunziekten en infectieziekten; verminderde CD4+ en CD8+ effectorgeheugencellen; verhoogde of verlaagde SARS-CoV-2 CD8+ T-cellen die cytotoxische markers uitdrukken bij patiënten met respiratoire symptomen of gastro-intestinale symptomen; verminderde uitgeputte lymfocyten (CD4+/CD8+ die PD1 tot expressie brengen) vóór klinische manifestaties van PCS; en in toegenomen uitgeputte lymfocyten in de herstelperiode van PCS.
Na hun initiële infectie met SARS-CoV-2 vertonen patiënten met PCS een ontregeling van de Treg-celfunctie. Deze cellen spelen een cruciale rol in de zelftolerantie door de T-celproliferatie en cytokineproductie te remmen en auto-immuniteit te voorkomen.
Over het geheel genomen onderstrepen de afwijkingen in het immuunfenotype van patiënten met PCS een verlengde antivirale immuunrespons, die vaak voorkomt bij chronische blootstelling aan virale antigenen en virale persistentie.
Persistentiemarkers
Verschillende onderzoeken hebben componenten van virale persistentie gevonden die symptomen van PCS kunnen uitlokken (in het bijzonder gastro-intestinale symptomen) zoals virale eiwitten (spike en nucleocapsid) en/of virale proteïnen en/of
SARS-CoV-2 RNA in ontlasting, plasma, urine, de hersenen, spieren, ogen, lymfeklieren, cardio-vasculaire organen, de lever en longweefsel. Een histopathologische studie van geïnfecteerde weefsels door het uitvoeren van autopsies op 44 COVID-19 gevallen is SARS-CoV-2 RNA gevonden op 84 verschillende anatomische plaatsen tot 230 dagen na infectie! [11]
Interessant is dat, ondanks het feit dat viraal RNA niet detecteerbaar was in plasma, onder alle overleden gevallen, virale persistentie werd vastgesteld in een groot aantal weefsels met behulp van hooggevoelige digitale PCR, wat de aanhoudende aanwezigheid van een lage virale belasting in biospecimens van COVID-19-patiënten aantoont.
Bovendien hebben intestinale endoscopische onderzoeken, met name bij patiënten
met inflammatoire darmaandoeningen (IBD), de aanwezigheid van SARS-CoV-2 in het darmepitheel of de ontlasting aangetoond, zelfs na 6 maanden na infectie met COVID-19. Dit wijst op een potentieel viraal reservoir dat aanhoudende ontstekingen veroorzaakt! [37]
Interessant is dat aantoonbaar SARS-CoV-2 RNA in ontlastingmonsters en verhoogde circulerende spike, S1- en nucleocapside (N)-antigenen gevonden is bij kinderen met MIS-C (Multisystem Inflammatory Symptoms in Children) in vergelijking met kinderen met acute COVID-19 wat suggereert dat virale persistentie hyperinflammatoire reacties kan uitlokken die MIS-C veroorzaken. [38]
Over het geheel genomen heeft het huidige beschikbare bewijsmateriaal aangetoond dat de duur van de SARS-CoV-2 infectie in veel gevallen langer kan aanhouden dan bepaald door PCR-negatieve tests op nasopharyngeale swabs of bronchoalveolaire lavagevloeistoffen.
Aanhoudende laaggradige multisysteemontsteking bij zowel volwassenen als kinderen kan worden toegeschreven aan een slepende SARS-CoV-2 infectie of herinfectie. Het gebruik van antivirale middelen tegen SARS-CoV2, zoals ImmunoMyk zou virale reservoirs kunnen uitroeien en de symptomen van PCS kunnen verzachten.
Humorale en cellulaire markers
Adaptieve immuunresponsen zijn de sleutel voor de beheersing van virale infectie, de ernst van de infectie en de bescherming tegen herinfectie. Tijdens acute infectie, zijn immuunreacties cruciaal voor het tot stand brengen van de gecoördineerde immuunrespons die nodig is voor de ontwikkeling van antilichamen en geheugen-B-cellen. Klinische studies hebben aangetoond dat neutraliserende antilichamen tegen SARS-CoV-2 de ernst van de ziekte, het sterftecijfer en de ziekenhuisopname kan verminderen. T-cellen spelen een cruciale rol in COVID-19 immuniteit, ernst en mortaliteit. [12]
Biomarkers van reactivering van latente virussen
Herpesvirussen zijn alomtegenwoordig en kunnen een levenslange latentie opbouwen na primaire infectie. Het onvermogen om latentie te handhaven met gevolgen op korte of lange termijn kan worden veroorzaakt door andere infecties. In een recente meta-analyse was de prevalentie van actieve herpesvirusinfecties bij COVID-19-patiënten: 41% voor EBV, 3% voor HHV-6, 28% voor HSV, 25% voor CMV, 22% voor HSV1 en 18% voor VZV, terwijl ernstige COVID-19 geassocieerd is met een 6-voudig hogere kans op actieve EBV-infectie. Opmerkelijk is dat EBV-reactivering in de acute fase van COVID-19 infectie geassocieerd is met ernstige COVID-19. [12]
Gereactiveerde herpesvirussen, met name EBV en HHV-6, werden gedocumenteerd bij patiënten met PCS. Wat betreft EBV-reactivering, EBV-viremie of verhoogde titers van
anti-EBV-antilichamen (IgM/IgG tegen viraal capside antigeen/VCA en IgG tegen EBV-
gecodeerd nucleair antigeen/EBNA) kunnen vroege voorspellende biomarkers van PCS zijn. Reactivatie kan kort na of gelijktijdig met COVID-19-infectie optreden. Eén
studie toonde aan dat vroege EBV-viremie geassocieerd kan worden met vermoeidheid en ademhalingssymptomen, terwijl in twee studies verhoogde antilichaamtiters tegen EBV werden geassocieerd met vermoeidheid, cognitieve disfunctie, hoofdpijn, psycho-neurologische stoornissen, ademhalingssymptomen en myalgie, en verhoogde leverenzymen, CRP en D-dimeer.
De reactivatie van EBV-infecties is ook gevonden bij patiënten met ME/CVS, wat suggereert dat EBV een belangrijke factor is voor de ontwikkeling van deze ziekte.
Een veranderd en chronisch opgewekt antiviraal profiel tegen latente virussen (EBV, HHV6 en humaan endogeen retrovirus K), met name IgG tegen EBV-gecodeerd nucleair antigeen-1 (EBNA1), werd vastgesteld bij patiënten met ME/CVS na milde/asymptomatische COVID-19. [39]
Auto-immuniteit markers
Infecties kunnen leiden tot antilichaam polyreactiviteit en autoimmuniteit, die over het algemeen als schadelijk worden beschouwd. COVID-19 omvat een breed spectrum van klinische phenotypen die overdreven en verkeerd gerichte immuunreacties van de gastheer vertonen. Patiënten met COVID-19 vertonen duidelijke verhogingen van de auto-antilichaamreactiviteit, met een verhoogde prevalentie van autoantilichamen tegen immunomodulerende eiwitten (bijv. cytokinen, chemokinen, complementcomponenten en celoppervlakeiwitten) die de immuunfunctie kunnen veranderen en de controle over het virus verliezen. Autoantilichamen, met name die welke type I IFN’s neutraliseren, zijn in verband gebracht met immuundisregulatie en ernst kans op overlijden. [40]
Onderzoeken hebben een overvloed aan autoantilichamen bij PCS, waaronder verhoogde ANA-antilichamen (bijvoorbeeld anti-U1-snRNP en anti-SS-B/La), antineuronale antilichamen, anti-IFN-antilichamen, autoantilichamen tegen ACE2,
de angiotensine II AT1 receptor, de angiotensine 1-7 MAS receptor, β2-de adrenoreceptor en de muscarine M2 receptor , waargenomen. De aanwezigheid van antilichamen tegen specifieke chemokinen (CCL21, CXCL13 en CXCL16) was negatief geassocieerd met de ontwikkeling van PCS na 1 jaar na infectie. Het is mogelijk dat autoantilichamen tegen bepaalde chemokinen de uitkomst op lange termijn positief kunnen beïnvloeden van COVID-19 door het tegengaan of reguleren van de activatie, rekrutering en retentie van van geactiveerde T- en B-cellen.
Tot slot werden in sommige onderzoeken specifieke autoantilichamen in verband gebracht met klinische fenotypen van PCS. ANA’s werden geassocieerd met aanhoudende symptomen van vermoeidheid en dyspneu, antineuronale antilichamen in CSF en serum met cognitieve stoornissen, en anti-IFN-α2 of anti-IFN-λ autoantilichamen met respiratoire symptomen van PCS.
Endotheel- of vaatbiomarkers
Recente gegevens hebben aangetoond dat endotheelontsteking en -beschadiging bij COVID-19 kunnen leiden tot langdurige gevolgen voor de vasculaire functie. Endotheliopathie wordt ook waargenomen in PCS. Bovendien kunnen verhoogde
ontstekingsmediatoren in PCS leiden tot de upregulatie van celadhesiemoleculen
en angiogenesefactoren en het afwerpen van de beschermende glycocalyxmatrix van het capillair endotheel met als gevolg aanzienlijke veranderingen in de microvasculaire weerstand en hemodynamiek. De hechting van hypergeactiveerde neutrofielen aan haarvaten in de hersenen, longen, het hart en andere weefsels of organen kan verder betrokken zijn bij de pathogenese van PCS. [41]

In een recente observationele studie werd verhoogde endotheline-1, een biomarker die vasoconstrictie medieert, en verlaagde angiopoëtine-2, een biomarker van vasculaire angiogenese, gerapporteerd bij patiënten met PCS en vermoeidheid. Een verlaagde angiopoëtine-2 werd uitsluitend gevonden in PCS en zou een differentiatiebiomarker kunnen zijn tussen PCS en ME/CVS. [42] In een ander onderzoek werden angiopoëtine-1 en P-selectine, een eiwit dat wordt gesynthetiseerd door geactiveerde trombocyten en endotheelcellen en dat fungeert als een celadhesiemolecuul, gevonden met een uitstekende gevoeligheid en specificiteit voor het voorspellen van PCS-status.
Stolling en fibrinolyse markers
Endotheeldisfunctie en hypercoagulabiliteit kunnen bij sommige patiënten optreden tot ongeveer 1 jaar na herstel van COVID-19. Sommige patiënten met PCS ontwikkelen een genetische predispositie voor trombofilie op basis van de evaluatie van gerelateerde genetische polymorfismen. Patiënten met PCS kunnen abnormale fibrine amyloïde microklonters krijgen die haarvaten blokkeren en weefselhypoxie, disfunctie van de zuurstofuitwisseling en weefselschade bij herstel van de zuurstofvoorziening veroorzaken (ischemie-reperfusie letsel). Deze microklonters, die resistent zijn tegen fibrinolyse, kunnen oxidatieve stress en de afscheiding van proinflammatoire cytokinen veroorzaken, waardoor een vicieuze cirkel ontstaat die
die betrokken kan zijn bij de vele klinische verschijnselen die bij PCS worden waargenomen. [13]
Verschillende onderzoeken hebben aangetoond dat er microklonters werden geïdentificeerd in het plasma van patiënten met PCS, met veranderde niveaus van stollings- en fibrinolyse-eiwitten, die betrokken zijn bij endotheelschade, activering van bloedplaatjes, stolling en fibrinolyse, zoals ondermeer von Willebrand factor (vWF), bloedplaatjes factor 4, fibrinogeen ketens α en β, factor XIII, plas-
minogeen en antiplasmine (α2AP), en verlaagd plasma kallikrein. Talrijke
pro-inflammatoire moleculen, zoals SAA, antilichamen en complementcomponenten die vastzitten in microklonters, werden ook gedetecteerd door proteomics in PCS.
ME/CVS wordt ook gekenmerkt door substantiële en meetbare veranderingen in bloedplaatjes hyperactivatie, stolbaarheid en fibrinoïde microklontervorming; desondanks is de belasting met microklonters in PCS groter.
Een meta-analyse van 23 prospectieve en retrospectieve onderzoeken met 18 meta- geanalyseerde biomarkers heeft aangetoond dat een verhoogd D-dimeer een diagnostisch nut heeft bij PCS, zij het van geringe invloed. D-dimeer is aanwezig bij sommige patiënten met orgaanafwijkingen en bij patiënten met een duur van de symptomen van meer dan 6 maanden.
Opvallend is dat abnormale D-dimeerwaarden gevonden bij kinderen met PCS en persisterende symptomen na 12 weken na de infectie in vergelijking met kinderen die na 8-12 weken volledig hersteld waren.
Samengevat, onderstrepen deze bevindingen de bijdrage van endotheliopathie, coagulopathie en falende fibrinolyse in de pathogenese van PCS.
Hormonale en metabolische markers
Endocriene disfunctie kan ook een rol spelen in de pathogenese van PCS. Twee longitudinale studies hebben aanhoudend lage cortisolniveaus gerapporteerd als een robuust onderscheidend kenmerk tussen tussen patiënten met PCS, herstellende patiënten en gezonde mensen. Het plasmacortisol bij patiënten met PCS was de helft van dat bij leeftijds-, geslacht en BMI-gematchte controles op 400 dagen na infectie, terwijl hypocortisolemie de meest significante voorspeller is voor het optreden van PCS.
Lage plasmaspiegels van cortisol in combinatie met de aanwezigheid van anti-IFN autoantilichamen werden gevonden bij patiënten met PCS en ademhalingssymptomen 3 maanden later. Vreemd genoeg was de lage cortisolsecretie door de bijnieren niet gecompenseerd door een toename van het adrenocorticotroop hormoon (ACTH), wat wijst op een disfunctie in de hypothalamus-hypofyse-bijnieras (HPA-as). Deze
disfunctie komt overeen met klinische verschijnselen die aanwezig zijn bij primaire bijnierinsufficiëntie (ziekte van Addison), zoals vermoeidheid, hersenmist, spierzwakte, misselijkheid, abdominale pijn, haaruitval, angst of depressie, enz. Hypocortisolemie met de hyporesponsiviteit van de HPA-as en chronische vermoeidheid worden ook waargenomen bij patiënten met ME/CVS, chronische stressstoornis en fibromyalgie en sommige postvirale infecties, zoals post-SARS en post-MERS. Laag cortisol is goed gedocumenteerd bij acute COVID-19.
De triade van hypocortisolemie, reactivatie van EBV en T-celuitputting is ook gerapporteerd bij ME/CVS, dat een aanzienlijk percentage van de PCS-patiënten uitmaakt. [33]
Wat betreft andere hormonale en metabole veranderingen, werd een laag cortisol geassocieerd met dysosmie/dysgeusie in een retrospectieve analyse van 186 patiënten met PCS. Laag serum groeihormoon en verhoogd serum FT4 werden in verband gebracht met algemene vermoeidheid, terwijl hogere thyrotropine (TSH) en lagere FT4/TSH ratio werden gevonden in de aanvankelijk ernstige PCS-gevallen. In een ander retrospectief cohortonderzoek vertoonden patiënten met PCS een verhoogde nieuw ontstane IR (Insuline Resistentie), terwijl een verhoogde IR significant samenhangt met depressieve symptomen. Opmerkelijk is dat lager adiponectine, dat wordt geassocieerd met obesitas, metabool syndroom, IR en kanker, werd vaker aangetroffen in verteerde microklonters van PCS-patiënten vergeleken met de controlegroep. Tot slot was er een 42% relatieve afname in de incidentie van PCS in een metforminegroep vergeleken met de geblindeerde controle in een gerandomiseerd onderzoek onder 1125 volwassenen in de VS in de leeftijd van 30 tot 85 jaar met overgewicht of obesitas. [34]

Een groeiende hoeveelheid bewijs op basis van meta-analyses, observationele
prospectieve en retrospectieve onderzoeken en interventiestudies heeft associaties aangetoond tussen hypovitaminose D en het optreden van acute ernstige COVID-19, waaronder een verhoogd risico van opname op de ICU, verblijfsduur op de ICU, behoefte aan mechanische beademing en sterfte. Vitamine D heeft bekende extra-skeletale eigenschappen, waaronder de regulatie van zowel aangeboren als adaptieve immuniteit en verhoogde activiteit tegen virussen, bacteriën en schimmels door de inductie van cathelicidine en defensines.
Bovendien zijn de gunstige effecten van vitamine D erkend in cardiometabolische, respiratoire, neurocognitieve en musculoskeletale gezondheid.
In een cross-sectioneel gecontroleerde studie was een lagere 25OHvitD-spiegel een onafhankelijke voorspeller van het optreden van PCS en kenmerkte patiënten met neurocognitieve symptomen bij follow-up.
Opvallend is dat de Nederlandse therapeutische waarde (50-150 nmol/l) veel lager ligt dan de internationale waarde (180-220 nmol/l) van vitamine D in het serum.
Eiwitmarkers
In een prospectief longitudinaal cohortonderzoek onder 2320 deelnemers die uit het ziekenhuis werden ontslagen, zijn plasmaproteoomgegevens gevonden van 13 ontstekingseiwitten geassocieerd met de ernstige groep PCS. De hoogste eiwitconcentratie was trefoil factor 2 (TFF2), een eiwit dat samen met mucine vrijkomt uit mucosaal epitheel van long- en maagslijmvlies, wat wijst op aanhoudende mucosale epitheliale afwijkingen en ontstekingscelactivatie.
De toename van IL-6 en CD70 werd in verband gebracht met cognitieve stoornissen, wat de rol van CD70 bij neuroinflammatie in het CZS benadrukt. Bovendien werd een hoger serum Agrine vastgesteld bij oudere volwassenen met sarcopenie, dat in verband gebracht wordt met lichamelijke beperkingen.
In een ander longitudinaal proteomisch case-control onderzoek onder 156 werknemers in de gezondheidszorg werd een plasma proteomische signatuur geassocieerd met lipiden, atherosclerose en cholesterolmetabolisme path-ways, complement- en stollingscascades, autofagie en lysosomale functies dat op het moment van seroconversie het potentieel had om patiënten te voorspellen die een grotere kans hadden op lijden aan PCS.
Ten slotte werd in een andere proteomische studie bewijs gevonden van een falend fibrinolytisch systeem in PCS geassocieerd met de insluiting van veel ontstekingsbevorderende eiwitten, die belangrijk kunnen zijn voor patiënten met reeds bestaande comorbiditeiten, waaronder hart- en vaatziekten en DMII. [14]
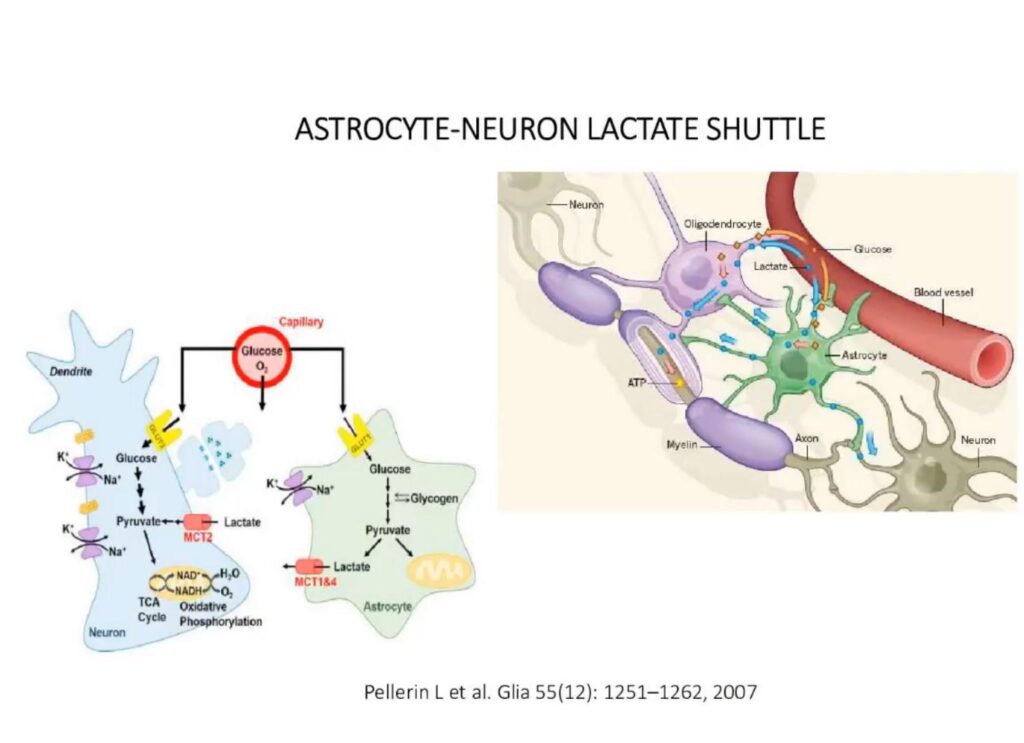
Metabolieten markers
Metabolomics zijn een hulpmiddel voor diagnostische, prognostische en medicamenteuze analyse in COVID-19 en in PCS. Metabolomics zijn niet-invasieve bepalingen van plasma- en weefselmetabolieten die met mitochondriën te maken hebben. Alhoewel er geen kenmerkende metabolietsignatuur is die geassocieerd wordt met PCS, hebben sommige onderzoeken aangetoond dat PCS, zelfs als er geen sprake is van ernstige acute COVID-19, de volgende kenmerken kan vertonen:
- een veranderd vetzuurmetabolisme en een disfunctioneel mitochondria-afhankelijk lipidekatabolisme in overeenstemming met eerder gerapporteerde mitochondriale disfunctie tijdens inspanning en verminderde vetzuuroxidatiecapaciteit van mitochondriën;
- een verstoord pyruvaat/lactaat metabolisme gekenmerkt door verlaagde niveaus van carbonzuren;
- een accumulatie van vrije en carnitine-geconjugeerde vetzuren geassocieerd met erytrocyten disfunctie, die de zuurstoftoevoer naar weefsels kan belemmeren;
- een activering van de kynurenine pathway, waarbij specifiek de verhoging van de metabolieten quinolinezuur, 3-hydroxyanthranilzuur en kynurenine in verband wordt gebracht met cognitieve stoornissen in PCS;
- een ontregeling in het sfingolipidenmetabolisme die geassocieerd zou kunnen worden met vermoeidheid en spierpijn bij PCS.
Over het geheel genomen zijn, gebaseerd op metabolomics-onderzoeken, mitochondriale dysfunctie, een verstoord energiemetabolisme, een veranderd vetmetabolisme en een onevenwichtige redoxtoestand, PCS kenmerken. [15] IHHT therapie is een veelbelovende interventie gericht op de bevordering van mitochondriale biogenese en het herstel van de mitochondriale functie.
Microbiota
Darmdysbiose kan bijdragen aan de ontwikkeling van verschillende metabole, autoimmuun- en ontstekingsziekten, waaronder ME/CVS. Verschillende onderzoeken
hebben de replicatie van SARS-CoV-2 in menselijke enterocyten en de detectie ervan in ontlastingmonsters en een veranderde samenstelling van de darmmicrobiota bij patiënten met COVID-19 aangetoond, die correleren met de ernst van de ziekte en ontstekingsbiomarkers. Darmdysbiose kan blijven bestaan na het verdwijnen van de infectie en betrokken blijven bij PCS. Op basis van enkele prospectieve follow-upstudies bij herstelde COVID-19-patiënten en controles, blijken de darmmicrobiota een rol te spelen bij PCS waarbij een dysbiose een jaar na ontslag aanwezig is bij herstelde COVID-19-patiënten, wat voorspellend is voor het optreden van PCS. [16]
Patiënten met PCS kunnen de volgende intestinale kenmerken vertonen:
- Verminderde bacteriële diversiteit;
- Lagere relatieve overvloed aan korte-keten vetzuren (SCFA) producerende nuttige symbionten, zoals Eubacterium hallii groep, Subdoligranulum, Ruminococcus, Dorea, Coprococcus en Eubacterium_ventriosum;
- Lagere niveaus van butyraatproducerende bacteriën die worden geassocieerd met PCS op 6 maanden;
- Verhoogde overvloed van Ruminococcus gnavus en Bacteroides vulgatus en een verminderde overvloed van Faecalibacterium prausnitzii.
De overdracht van microbiota van mensen met PCS bij muizen, veroorzaakte een achteruitgang in de cognitieve eigenschappen van de hersenen en een disfunctionele longafweer bij muizen, die gedeeltelijk werd voorkomen door toediening van het commensale probioticum Bifidobacterium longum. Probiotica, prebiotica en synbiotica, waarvan is aangetoond dat ze gunstige metabolische en immunologische eigenschappen bezitten, zouden in de toekomst gebruikt kunnen worden als aanvullende therapeutische middelen bij PCS.
Tot slot, hoewel er geen gegevens zijn over veranderingen in de mycobiota bij PCS, is in een onderzoek een verhoogde niveaus van schimmel translocatie vanuit de darm en/of de longepithelia, (β- glucan, een schimmelcelwandpolysacharide) in het plasma van mensen met PCS aangetroffen, wat suggereert dat schimmeltranslocatie een belangrijke rol speelt bij chronische immuunactivatie door permeabiliteit van de darmbarrière.
In het algemeen suggereren al deze bevindingen dat de configuratie van het darmmicrobioom van een individu op het moment van SARS-Cov-2 infectie de gevoeligheid voor complicaties van COVID-19 op de lange termijn kan veranderen.
Bovendien hebben intestinale endoscopische onderzoeken, met name bij patiënten
met inflammatoire darmaandoeningen (IBD), de aanwezigheid van SARS-CoV-2 in het darmepitheel of de ontlasting aangetoond, zelfs na 6 maanden na infectie met COVID-19. Dit wijst op een potentieel viraal reservoir dat aanhoudende ontstekingen veroorzaakt!
Cerebrospinaal Vloeistof markers
Analyse van cerebrospinaal vocht (CSF) is een diagnostische pijler bij neuroinflammatoire aandoeningen.
In een systematische review werden niet-specifieke inflammatoire afwijkingen in de liquor vaak gevonden bij patiënten met COVID-19 met neurologische symptomen.
Neurodegeneratiebiomarkers kunnen duiden dat neuronale schade onbekende langetermijngevolgen kan hebben. In een retrospectieve multicenteranalyse van 150 lumbaalpuncties bij 127 patiënten met PCR-bewezen COVID-19 en neurologische betrokkenheid, is aangetoond dat het CSF-profiel markers van verstoring van de bloed-hersenbarrière (BBB) aanwezig zijn, in afwezigheid van intrathecale ontsteking, wat compatibel is met cerebrospinale endotheliopathie.
Hyperalbuminorrachia en verhoogde niveaus van het astrogliale eiwit S100B, suggestief voor BBB-disfunctie, werden gevonden in een longitudinale studie van COVID-19-patiënten met neurologische manifestaties.
Deze BBB-disfunctie en de verhoogde niveaus van cytokinen en chemokinen kunnen betrokken zijn bij zowel acute neurologische symptomen als bij PCS. Een ander onderzoek bij patiënten met neuro-COVID toonde een toename van CSF-biomarkers van neuroinflammatie en lichte keten neurofilament, indicatief voor neuronale schade.
In een cross-sectionele en lange-termijn longitudinale onderzoek met een multiomics-benadering waren de belangrijkste tekenen van ernstige neuro-COVID de disfunctie van de bloed-hersenbarrière, verhoogde biomarkers voor microglia-activatie en een polyklonale B-celrespons gericht op zelfantigenen en niet-zelfantigenen. Patiënten met neuro-COVID vertoonden verminderde regionale hersenvolumes gerelateerd aan specifieke CSF markers; desondanks vertoonden COVID-19 patiënten met een cytokine storm geen inflammatoir CSF-profiel.
PCS komt vaker voor bij patiënten met ernstige neuro-COVID en is gekoppeld aan specifieke plasma- en CSF biomarkers. In een langetermijnfollow-uponderzoek werden lage niveaus van het ontstekingsremmende eiwit TRANCE (RANKL) in combinatie met verhoogde niveaus van het pro-inflammatoire eiwit TNFRSF9 en IFN-γ de beste voorspellers van afzonderlijke eiwitten in CSF voor PCS.
Het chemotactisch eiwit (MCP)-3 en ST1A1, die betrokken zijn bij de activatie en infiltratie van macrofagen en monocyten in het centrale zenuwstelsel (CZS) en bij auto-immuunencefalitis, kunnen PCS voorspellen. Na milde COVID-19 kan een aanhoudende ontstekingsreactie mogelijk een belangrijke aanwijzing zijn in de pathogenese van PCS met neurologische symptomen gebaseerd op bevindingen in de liquor bij proefpersonen met cognitieve stoornissen die zich één tot zes maanden na herstel ontwikkelden. [17]
In een prospectieve case-control studie van 60 gehospitaliseerde neuro-COVID
patiënten waren alleen de niveaus van proteïne 14-3-3 en neurofilament lichte keten (NfL) in de liquor, die biomarkers zijn van neuroaxonale schade, significant geassocieerd met een mate van neurologische schade bij dagelijkse activiteiten na 18 maanden follow-up.
Over het geheel genomen zijn al deze biomarkers geassocieerd met neuropathologische mechanismen, waaronder cy-perifeer geïnduceerde cytokineveranderingen, gevolgd door disfunctie van de bloed-hersenbarrière met intrusieve polyreactieve autoantilichamen, endotheeldisfunctie en coagulopathie, verhoogde reactiviteit van microglia, neuro-inflammatie en neuronale schade.
Biomarkers die klinische manifestaties classificeren bij Post-COVID
PCS is een heterogene complexe multisysteemaandoening met verschillende klinische manifestaties. Daarom zou het ideaal zijn om het te categoriseren voor diagnostische, prognostische en therapeutische doeleinden. Ondanks het feit dat de meerderheid van de biomarkers die in dit overzicht betrekking hebben op de totaliteit van PCS, worden kandidaat-specifieke biomarkers voor belangrijke onderscheidende klinische kenmerken van PCS ingedeeld in de volgende groepen:
- Algemene symptomen waaronder vermoeidheid en spierpijn;
- Ademhalingssymptomen;
- Neurologische symptomen;
- Gastro-intestinale symptomen.
Biomarkers voor algemene symptomen en vermoeidheid
In het algemeen zijn veranderde niveaus van D-dimeer, LDH en lymfocyten kenmerkend voor patiënten met orgaanafwijkingen die werden geëvalueerd door middel van beeldvorming en functionele onderzoeken, terwijl verhoogde IL-6-, D-dimeer- en CRP-spiegels werden waargenomen bij sommige patiënten met aanhoudende van symptomen (meer dan 6 maanden). [43]
Opmerkelijk is dat D-dimeer verhoogd is bij kinderen met PCS en aanhoudende symptomen. Bij sommige patiënten zijn verhoogde concentraties van IL-6 en CRP informatief voor het vroege stadium van PCS. Symptomen van vermoeidheid en lichamelijke beperkingen worden geassocieerd met vroege EBV-viremie; verhoogde
antilichaamtiters tegen EBV, antispike SARS-CoV-2 IgG in 2 maanden na infectie en ANA’s; hoger serum endotheline-1, agrine en FT4; lagere angiopoëtine-2, cortisol en groeihormoon en veranderde metabolieten in het sfingolipidenmetabolisme.
Opvallend is dat verlaagde angiopoëtine-2 uitsluitend werd gerapporteerd in PCS,
wat PCS onderscheidt van ME/CVS. [42]

Figuur 2. Biomarkers die de klinische manifestaties bij Post-COVID (PCS) classificeren. Afkortingen: ↑, verhoogd; ↓, verlaagd; ANA’s, antinucleaire antilichamen; CMV, Cytomegalovirus; CRP, C-reactief proteïne; CSF, cerebrospinaal vocht; EBV, Epstein-Barr Virus; GFAP, gliaal fibrillair zuur pro- bleem; GH, groeihormoon; GFAP, gliaal fibrillair zuur proteïne; HOMA-IR, Homeostatic Model Assessment for Insulin Resistance; IFN, interferon; IL, interleukine; LBP, Lipopolysaccharide Binding Protein; MCP, monocyte chemotactic protein; NfL, neurofilament light chain protein; NK, natural killer; SARS-CoV-2, Severe Acute Respiratory Syndrome Coronavirus 2; TNF, tumor necrose factor (afbeelding is afkomstig van de gratis medische site http://smart.servier.com
Biomarkers voor neurologische symptomen
Neurologische symptomen komen vaak voor bij PCS en zijn geassocieerd met verhoogde niveaus van proinflammatoire cytokines IL-6, MCP-1 en TNF-α bij patiënten. [44]
Cognitieve disfunctie werd geassocieerd met de reactivatie van EBV; verhoogde CCL11, IL-6, CD70 en antineuronale antilichamen; verhoogde concentraties S-sulfocysteïne; en hogere niveaus van metabolieten van de kynurenine-route (kinolinezuur, 3-hydroxyanthraniliczuur en kynurenine). In CVS is cognitieve stoornis geassocieerd met een hogere frequentie van afwijkingen in de liquor en abnormale oligoklonale banding; een hogere frequentie van antineuronale antilichamen; en verhoogde niveaus van de eiwitten 14-3-3 en NfL. Verhoogde spiegels van cytoskelet eiwitten NfL en gliaal fibrillair zuur proteïne (GFAP), die de stabiliteit van neuronale axonen en astrocyten handhaven, en β- glucan werden in verband gebracht met hevige hoofdpijn en aanhoudende neuropathische pijnen bij patiënten met
PCS. [44] Depressieve symptomen werden in verband gebracht met nieuw ontstane IR, zoals uitgedrukt door een verhoogde Homeostatic Model Assessment for Insulin Resistance (HOMA-IR) score, terwijl dysosmie/dysgeusie werd geassocieerd met laag serumcortisol en zink. Tot slot zijn verhoogde niveaus van exosomen die SARS-CoV-2-eiwitten bevatten en lagere niveaus van mitochondriale eiwitten, veelbelovende biomarkers voor neuropsychiatrische symptomen.
Biomarkers voor ademhalingssymptomen
Pulmonale laesies zijn frequente gevolgen van SARS-CoV-2 infectie bij een aanzienlijk deel van de COVID-19 patiënten.
Herstelde patiënten van eerdere varianten vertoonden restlesies in de longen, zoals ground-glass opacity en fiber streak shadow. Hoest en dyspneu zijn de meest voorkomende en aanhoudende symptomen die langer dan 7 maanden duren bij respectievelijk 20% en 40% van de patiënten. In een onderzoek met herstellende patiënten, een jaar na ontslag, vertoonden patiënten met pulmonale restverschijnselen een prominente immunologische profilering, gekenmerkt door de activering van cytotoxische T-cellen, markers van uitputting en senescentie, NK-cellen en γδ T-cellen, evenals een tekort aan onderdrukkende cellen. [45] Bij andere
patiënten werden ademhalingssymptomen geassocieerd met vroege EBV-viremie en verhoogde antilichaamtiters, verhoogde ANA’s en anti-IFN-α2 of anti-IFN-λ au-antilichamen, laag plasmacortisol en hoger S-sulfocysteïne.
Tot slot heeft een ander onderzoek aangetoond dat patiënten met ademhalingssymptomen van PCS hogere niveaus van CRP, IL-6 en SARS-CoV-2-CD4+/CD8+ T-cellen vertoonden die IFN-γ of TNF-α uitscheidden, 7 maanden na infectie. [45]
Biomarkers voor gastro-intestinale en andere specifieke symptomen
Veelbelovende biomarkers voor gastro-intestinale manifestaties bij PCS en MIS-C zijn onder andere SARS-CoV-2 RNA in de ontlasting en verhoogde circulerende virale eiwitten (S, S1, N) en verhoogde niveaus van zonuline, LPB, β-glucaan, autoAb La/SS-B en CMV-specifieke CD8+ T-cellen evenals verhoogde SARS-CoV-2-specifieke CD8+ T-cellen die cytotoxische markers uitdrukken.
Tot slot bleek uit een prospectieve observationele studie één jaar na het ontslag uit het ziekenhuis van 263 herstelden van COVID-19 dat 26,2% haarverlies had. Lagere niveaus van Arrest-Specific 6 (Gas6) en zijn oplosbare receptor Axl (sAxl) zijn geassocieerd met alopecia. [46]
Beperkingen
In dit artikel zijn biomarkers met betrekking tot PCS beoordeeld en samengevat. In de homeostase hebben alle processen invloed op elkaar. Daarbij kunnen patiënten die aan de PCS-definitie voldoen al dan niet objectieve orgaanschade vertonen, hetgeen weer van invloed kan zijn op diverse andere, niet genoemde bepalingen in serum en/of ontlasting.
Misclassificatie kan ontstaan wanneer het moeilijk is om langdurige symptomen die mogelijk worden toegeschreven aan PCS te onderscheiden van symptomen die het gevolg zijn van andere aandoeningen zoals ME/CVS, MS, burn-out, MCAS, Fibromyalgie etc. Overigens biedt de overlap aan symptomen en afwijkingen in de bepalingen ook nieuwe mogelijkheden om ook deze aandoeningen beter te begrijpen en te behandelen.
Een andere belangrijk element is de afhankelijkheid van zelfgerapporteerde
informatie over PCS status, wat kan leiden tot selectiebias. De timing van het
begin van de symptomen is ook onderhevig aan vertekening door herinneringen, vooral wanneer de informatie vele maanden na acute COVID gemeld worden.
Wat nog belangrijker is, is dat sommige onderzoeken zich richtten op cohorten die in het ziekenhuis waren opgenomen en die niet representatief zijn voor de algemene bevolking.
Ook stranden uitzonderlijk veel Post-Covid-meldingen bij huisartsen en andere zorgverleners. Andere problemen zijn de vals-negatieve uitslagen van PCR-tests, die deelnemers als controles zouden kunnen classificeren, evenals het beperkte nut van antilichaamtiters om eerdere SARS-CoV-2 infecties vast te stellen.
Betrouwbare wetenschappelijke onderzoeken moeten voldoen aan een aantal belangrijke voorwaarden, normen en eisen op het gebied van gerandomiseerde placebogecontroleerde, dubbelblinde en peerreview onderzoeken etc.
Tot slot worden er nog steeds veel internationaal wetenschappelijke onderzoeken gedaan, met weer nieuwe conclusies en inzichten. Het Post-Covid Syndroom is nog een relatief jonge aandoening waarbij bijna maandelijks voortschrijdend inzicht gerapporteerd wordt. Hoewel de overeenkomst met aanpalende aandoening zoals ME/CVS etc bijzonder groot is, heeft het PCS er wel toe geleid dat er ineens veel meer wetenschappelijk onderzoek is ontstaan. Kennis van nu is over een half jaar mogelijk al weer niet compleet.
Therapeutische perspectieven en uitdagingen
De meeste therapeutische benaderingen tegen PCS zijn gericht op symptoombestrijding. Internationale samenwerking en het delen van kennis is daarom van groot belang om te komen tot een gezamenlijk, doelmatige aanpak van PCS. om tijdig “rode vlag” kenmerken te herkennen die wijzen op onderliggende objectieve systemische aandoeningen die waarschijnlijk een beslissende invloed hebben op de prognose van de patiënt.
Idealiter zou de eerstelijnsgezondheidszorg gebaseerd moeten zijn op uniforme evaluatiealgoritmen en gestandaardiseerde procedures. Met betrekking tot patiënten met “red flag” symptomen of symptomen van invaliderende omvang, moet verdere doorverwijzing naar specialistische zorg plaatsvinden naar interdisciplinaire ambulante COVID-klinieken, die adequate toegang bieden tot gespecialiseerd behandelingen en die in wezen fungeren als een schakel tussen de eerstelijns- en ziekenhuiszorg.
Samenwerken en het opzij zetten van persoonlijke belangen is hierbij een voorwaarde.
Het is niet verrassend dat voor een constellatie van symptomen en aandoeningen zo breed als die beschreven onder de overkoepelende term “PCS”, er niet één enkele therapeutische interventie bestaat met bewezen voordeel voor alle getroffen patiënten bestaat.
Helaas zien we dat de reguliere zorg zich vooral concentreert op het “off label” toepassen van bestaande medicatie en vaccinatie, waarbij met name de symptoombestrijding doel op zich is verworden.
Post-Covid therapieën
In Nederland zijn er de afgelopen jaren diverse therapieën opgezet. Deze variëren van psychotherapie, fysiotherapie, EMDR, revalidatie, immunotherapie, ergotherapie, voetzoolreflexie, hyperbare zuurstof, ozontherapie en een heel scala aan diëten. Post-Covid patiënten worden hierbij begeleid door een leger aan (zelfbenoemde) therapeuten. Vaak gemotiveerd om mensen te helpen, soms helaas ook vanuit een financiële drijfveer.
OxyFin®
Wat maakt de OxyFin®-therapie van Finesse Medical Center zo anders? OxyFin® maakt gebruik van de IHHT-techniek uit Duitsland die bekend is als succesvolle therapie bij intensieve professionele sporten en tal van aandoeningen als CVS/ME, COPD, dementie etc. IHHT wordt in Duitsland ook toegepast in diverse onderdelen van het leger en sinds een aantal jaren ook bij PCS.
Inmiddels zijn er 923 wetenschappelijke onderzoeken gedaan. IHHT heeft bewezen positieve effecten op cardiale, pulmonale, neurologische en metabole problematieken.
Hyperbare zuurstof (HBOT) versus OxyFin® (IHHT)
Bij hyperbare zuurstof wordt zuurstof onder hoge druk toegediend in de drukkamer. Deze therapie is vooral bekend bij caisson-ziekte bij duikers en bij mensen met een anaerobe bacterie. Bij post-Covid patiënten heeft deze methode meestal geen effect omdat het niet gaat om de hoeveelheid zuurstof (de meeste patiënten zitten al op 98-99% en die 1 of 2% erbij maakt niet het verschil). Probleem is dat de mitochondriën niet goed met de zuurstof overweg kunnen. Dus alleen patiënten met een lage saturatie van 88-89% merken tijdelijke verbetering van HBOT, maar de mitochondriën herstellen zich hierbij niet.
OxyFin®-therapie verlaagt juist de saturatie in een goed ontwikkelde cyclus van lage saturatie afgewisseld met hoge saturatie. Dit zorgt ervoor dat kapotte mitochondriën worden opgeruimd (gefagocyteerd), beschadigde worden gerepareerd en gezonde mitochondriën zich gaan delen.
IHHT of Altitude Training is een op zuurstof gebaseerde therapie waarbij een persoon afwisselend rondes van lage saturatie zuurstof (11-16%) inademt met hoge saturatieniveaus (21-35%). Dit simuleert omstandigheden op grote hoogte en zet het lichaam aan tot de welbekende aanpassingen die plaatsvinden wanneer we op hoogte komen of leven. Aanpassing aan hoogte helpt ons lichaam om fysiologische prestaties te verbeteren, zuurstofefficiënter te worden, de ademhalingsprestaties te verbeteren bij lagere zuurstofniveaus, fitter te worden en het metabolisme en uithoudingsvermogen te verhogen. Hoogtetraining wordt al jaren toegepast door top-atleten en professionele duursporters. [18, 24]

Intermittent Hypoxie Hyperoxie Therapie (IHHT)
IHHT wordt als niet-medicamenteuze behandeling gebruikt bij de klinische behandeling van chronische obstructieve longziekte (COPD), diabetes, coronaire hartziekte, hypertensie en andere ziekten. Veel klinische onderzoeken hebben bevestigd dat Intermittent Hypoxie Hyperoxie Therapie de cardiopulmonale functie van patiënten kan verbeteren, het zuurstofgehalte in het bloed en de tolerantie van weefsels en organen voor lagere zuurstofniveaus kan verhogen, de overactivering van het immuunsysteem kan remmen en acute longontsteking onder controle kan houden. Dit zijn symptomen die ook optreden als gevolg van blootstelling aan het Covid 19-virus. [19, 20]
- Mitochondriën hebben een belangrijke functie in het metabolisme en de immuunrespons. Ze zijn de spil van de immuniteit;
- Mitochondriën detecteren virussen (zowel DNA als RNA) en triggeren een sterke aangeboren immuunrespons via interferon en cytokinen;
- Het virus “kaapt” de mitochondriale processen om zijn eigen overleving te garanderen. Door de mitochondriën te dwingen tot meer fusie en het MAV-systeem te blokkeren, wordt de aangeboren immuunrespons verminderd;
- Het virus lokt mitochondriale disfunctie uit om te ontsnappen aan de immuuncontrole en wijzigt het metabolisme in zijn eigen voordeel (vooral door replicatie).
IHHT komt voort uit de IHT therapie die in de vorige eeuw in de Sovjetunie is ontwikkeld. Deze therapie bestond uit 5 cycli van 5 minuten hypoxie, gevolgd door een korte periode van normoxy (21%). Met het toevoegen van hyperoxie fasen ontstond de IHHT therapie. [35]
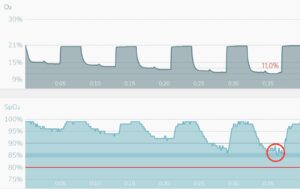
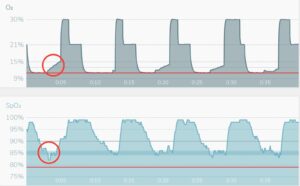
Intermittend Hypoxie Therapie Intermittend Hypoxie Hyperoxie Therapie
Bij IHT wordt de saturatie (zuurstofverzadiging in het bloed) stapsgewijs verlaagd in 5 cycli. Na iedere cyclus wordt deze saturatie hersteld naar normoxi (21% zuurstof).
Bij IHHT wordt iedere fase van hypoxi gevolgd door een fase van hyproxie (30% zuurstof). In beide gevallen wordt het doel (in beide voorbeelden 85%) gecontroleerd en indien nodig gecorrigeerd zodra de saturatie onder de grens dreigt te vallen (rode cirkel).
IHHT veroorzaakt een toename van het totale aantal mitochondriën, afname van beschadigde organellen, het verschijnen van energetisch actieve mitochondriën met vesiculaire cristae en de vorming van micromitochondriën (microMt). Aanpassing aan intermitterende hypoxische stimulatie veroorzaakt positieve veranderingen in het mitochondriaal apparaat van de cellen. Dit laatste manifesteert zich als Fission (delen) Fusion (verstrengelen) en Mitophagy (opruimen) van de Mitochondriën. Bovendien wordt de membraanintegriteit hersteld.
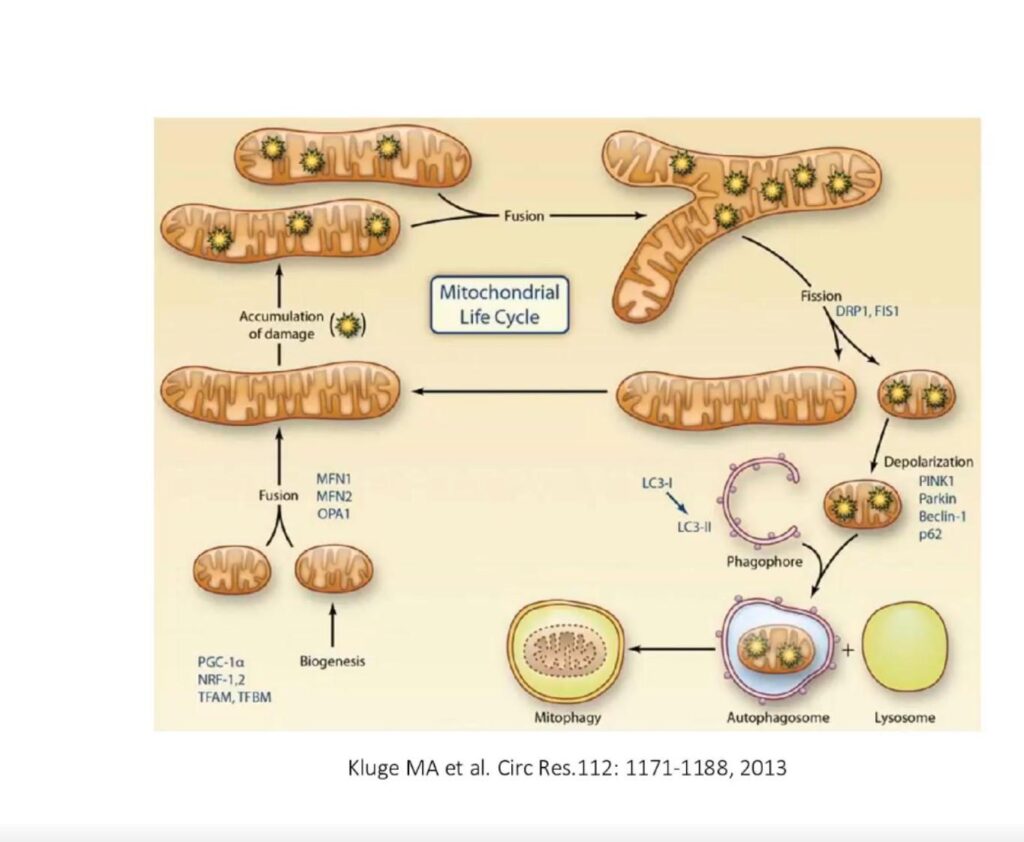
Het gebruik van IHT en vooral IHHT om oxidatieve stoornissen in de mitochondriën te herstellen is een effectieve procedure die de weerstand van de cellulaire structuren tegen acute hypoxie aanzienlijk verhoogt. Het gebruik van een dergelijke training remt sterk de ontwikkeling van mitochondriale disfunctie onder ernstige hypoxie, verlaagt oxidatieve schade aan mitochondriën en verhoogt de capaciteit van het endogene antioxidant systeem, emotionele stress, intensieve inspanning, etc.
De reactie van cellen op een gebrek aan zuurstof is van bijzonder belang voor het begrijpen van pathologische processen in het lichaam. Enkele jaren geleden werd bekend dat de belangrijkste rol in dit proces wordt gespeeld door een zuurstofgevoelig eiwitcomplex met transcriptionele activiteit, genaamd hypoxie-induceerbare factor (HIF).
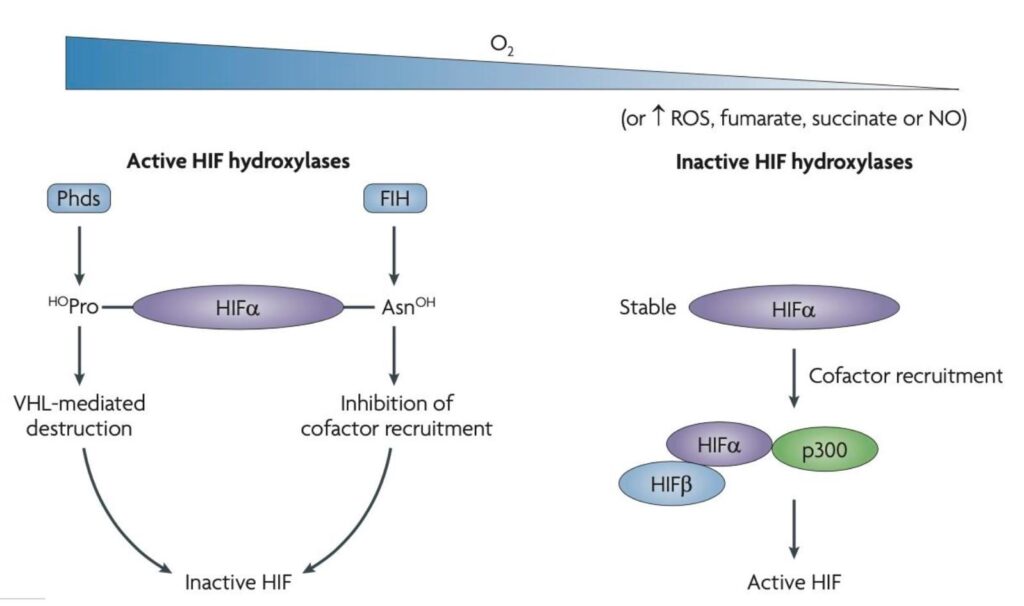
HIF is een heterodimeer transcriptioneel complex dat bestaat uit zuurstofafhankelijke α-subeenheden [HIF-1α, HIF-2α of HIF-3α] en zuurstofonafhankelijke β-subeenheid.
Aangetoond is dat HIF-1 een cruciale rol speelt bij het reguleren van de productie van vrije zuurstofradicalen in de mitochondriën via verschillende mechanismen: directe – regulering van biosynthese en autofagie van de mitochondriën, het herstructureren van het expressiepatroon van cytochroom c oxidase subeenheden, en indirecte – regulering van de expressie van pyruvaat dehydrogenase kinase-1 (PDK-1), die prolyl hydroxylase fosforyleert en inactiveert. In de studie naar de regulatie van mitochondriaal metabolisme via HIF-1 is aangetoond dat tijdens hypoxie en dus verhoogde ROS mitochondriale productie de expressie van HIF-1α en zijn doelgenen toeneemt. [18]

Dus enerzijds veroorzaakt HIF-1 de ontwikkeling van cellulaire aanpassing aan hypoxie door actieve verlaging van het zuurstofverbruik in de mitochondriën via PDK-1, dat in hypoxische omstandigheden glycolytische processen in de cel stimuleert en het autofagieproces opstart via BNIP-3. Anderzijds beïnvloedt HIF-1 de expressie van miR-210 dat de ernst van apoptose kan verminderen en de expressie van cytochroomoxidase subeenheid COX-4 reguleert, die gerelateerd is aan ATO. Anderzijds beïnvloedt HIF-1 de expressie van miR-210 die de ernst van apoptose kan verminderen en de expressie van de cytochroomoxidasesubeenheid COX-4 reguleert, die verband houdt met de ATP-productie, de snelheid van het zuurstofverbruik en de ROS-generatie in de mitochondriën. Het is duidelijk dat de verstoring van de werking van het HIF-systeem door Covid-Sars-2 de ontwikkeling van mitochondriale disfuncties kan veroorzaken.
In het bijzonder is gebleken dat onderdrukking van mitochondriale genen door doxorubicine, energiegevoelige moleculen worden beïnvloedt, zoals ATP-geactiveerd proteïne kinase (AMPK), HIF-1, nucleaire respiratoire factor 1 (NRF-1) en proliferator-geactiveerde receptor γ-co-activator-1α (PGC-1α). [47,48]
Proteomische analyse maakt het mogelijk om opeenvolgende veranderingen aan te tonen in eiwitten die betrokken zijn bij de mitochondriale energieproductie en antioxidant verdediging. Deze analyse toont ook aan dat de expressie van ten minste 9 eiwitten die betrokken zijn bij het mitochondriale energiemetabolisme zeer duidelijk toenam tijdens intermitterende hypoxie.
De verhoogde expressie van HIF-3α mRNA bij acute hypoxie en IHHT kan dus tot op zekere hoogte het gevolg zijn van de aanwezigheid in de promotor van dit gen van een element dat gevoelig is voor hypoxie. Deze toename dient als marker van HIF mRNA transcriptiefactoren en van hun doelgen erytropoëtine (EPO) in reactie op zelfs milde hypoxie. Moleculaire mechanismen die betrokken zijn bij de inductie van HIF-1α expressie bij intermitterende hypoxie, waaronder ROS-generatie door NADPH-oxidase, ROS-afhankelijke calciumsignaleringsroute die een activering van fosfolipase C-γ en een groep kinasen omvat zijn proteïne C, mTOR en S6-kinase. Als gevolg hiervan dragen de toename van de mTOR-afhankelijke synthese van HIF-1α en de afname van de prolylhydroxylase-afhankelijke afbraak van HIF-1α bij aan de accumulatie van HIF-1α tijdens de aanpassing aan intermitterende hypoxie.
Portnichenko et al. onderzochten de veranderingen in zuurstofverbruik, lichaamstemperatuur, HIF-1α en HIF-3α genexpressie in de longen van jonge en volwassen ratten, aangepast aan de effecten van chronische hypoxie op een hoogte van 2100 m, en de aanpassing aan intermitterende hypoxie. Er werden vier fasen van fysiologische veranderingen door IHT geïdentificeerd. De eerste fase, hypometabolisch (1-3 sessies), wordt gekenmerkt door verminderd zuurstofverbruik, verlaagde lichaamstemperatuur en inductie van HIF-1α en HIF-3α. In de tweede, overgangsfase (sessies 3-4) vindt herschikking van het metabolisme en vermindering van de hypoxische reactiviteit plaats. De derde fase, hypermetabolisch (4-5 sessies), wordt gekenmerkt door een verhoogd energiemetabolisme en compensatie van hypoxische stoornissen. De vierde fase (na de 5e sessie) is een toestand van metabole adaptatie met normalisatie van het zuurstofverbruik en de lichaamstemperatuur, expressie van HIF-1α en HIF-3α, mitochondriale respiratie, NAD-afhankelijke oxidatie van koolhydraat- en lipidensubstraten. Blootstelling aan IHT resulteerde in transcriptionele activering van het HIF-1α-gen in de longen en droeg bij aan het snelle herstel van het metabolisme van 6 maanden oude ratten. Bij de 12 maanden oude dieren werd de vorming van HIF-3α gemedieerde beschermingsmechanismen in de longen en een traag herstel van metabolische processen waargenomen. [23]
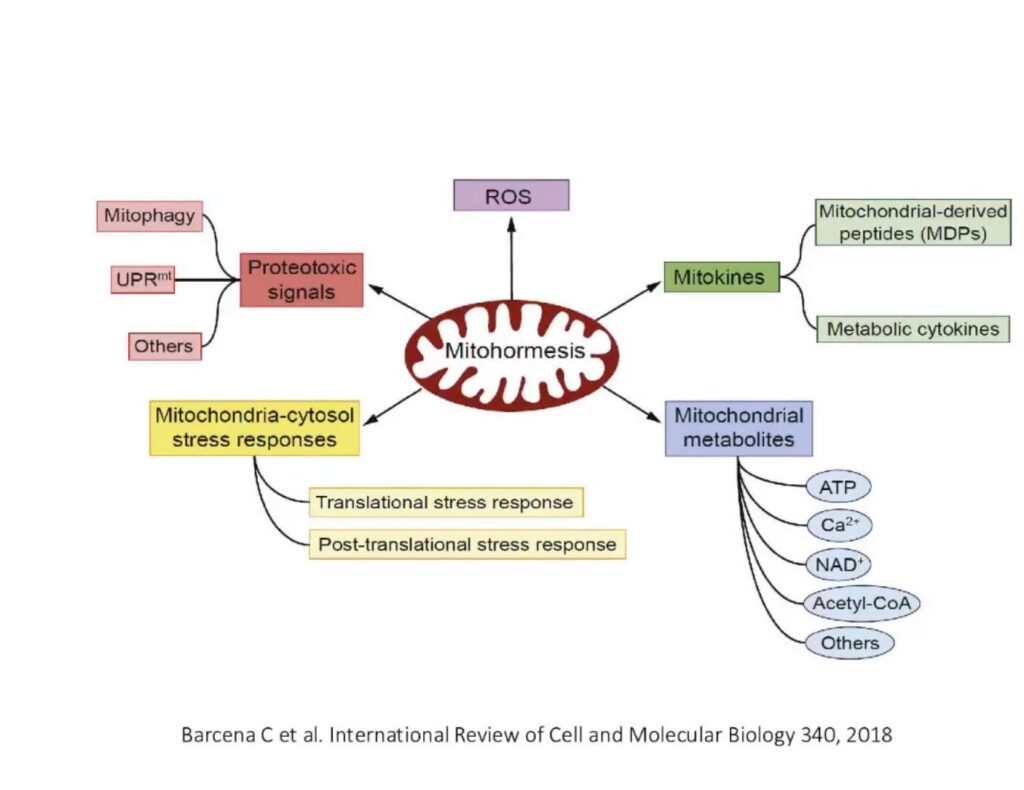
De regelmatigheid van de reactie van verschillende HIF-subeenheden op acute en intermitterende hypoxie kan belangrijk zijn bij het kiezen van IHT-protocollen om verschillende ziekten te voorkomen en te behandelen, maar ook om atleten te trainen.
Mitochondiële disfunctie: when your best friend becomes your worst enemy!
Bij het cellulaire ademhalingsproces is de citroenzuurcyclus van fundamenteel belang. Het is een metabool proces dat zuurstof gebruikt voor oxidatie van glucose, vetzuren en aminozuren. Dit oxidatieproces genereert energie in de vorm van ATP, NADH en FAD.
Adenosinetrifosfaat (ATP) is feitelijk een energiedrager. Een groot deel van ons metabolisme is erop gericht om ATP te genereren. Het proces heet oxidatieve fosforylering. Deze vindt in het binnenmembraan van de mitochondriën plaats.
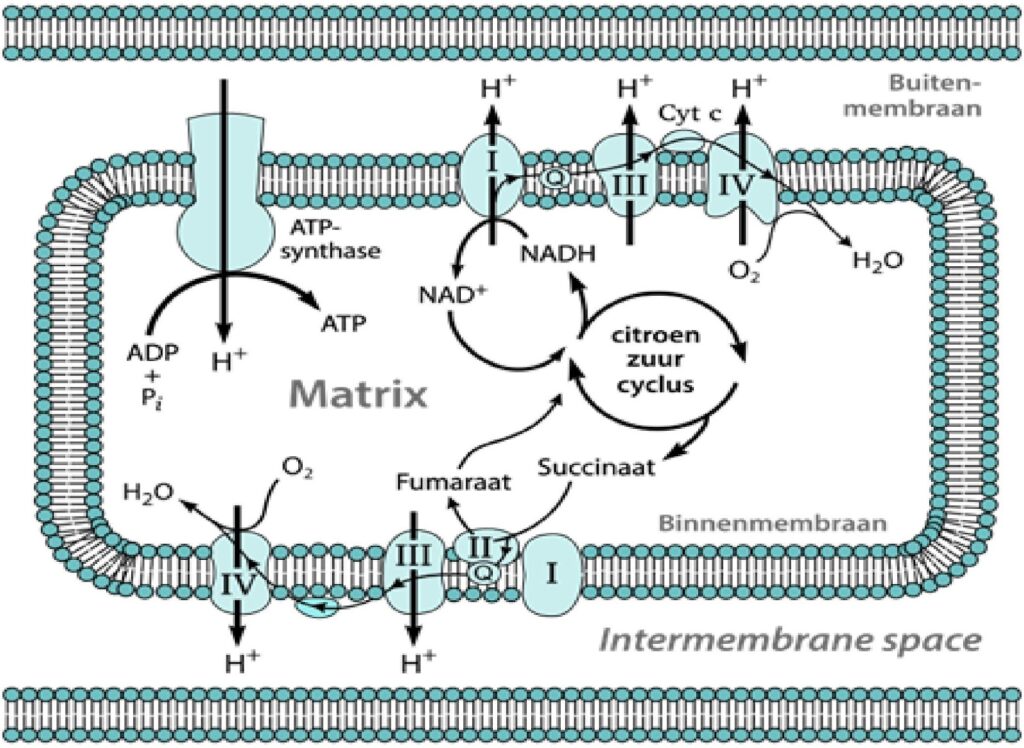
Nicotinamide-Adenine-dinucleotide (NADH)
Voedingsstoffen zoals koolhydraten, vetten, eiwitten worden in de mitochondriën afgebroken. Hierbij spelen ook vitaminen en mineralen een belangrijke rol. NAD is ook een energiedrager die elektronen uit suikers en vetzuren NADH maakt. Het NADH geeft positieve H+ ionen af aan de elektronentransportketen. Deze keten zit in het binnenmembraan van de mitochondriën en zorgt er voor dat alle energie niet in één keer vrijkomt.
Flavine-Adenine-dinucleotide (FAD)
Net als NAD is FAD voornamelijk betrokken bij katabole processen. Het neemt elektronen op tijdens de β-oxidatie van vetzuren en in de citraatcyclus. In de ademhalingsketen wordt de gereduceerde vorm weer geoxideerd en de elektronen worden gebruikt om ATP te synthetiseren.
Oxidatieve Fosforylering
Oxidatieve Fosforylering is zeer complex. In de context van deze paper wordt volstaan met het verwijzen naar deze complexiteit zonder uitgebreid op deze materie in te gaan. Complexiteit correleert tevens met fragiliteit. Binnen de oxidatieve fosforylering kunnen een aantal dingen misgaan. Als één onderdeel in de keten misgaat dan wordt de gehele cyclus onderbroken. Hierdoor houdt het oxidatieproces van ATP en NADH op en worden er geen H+ ionen meer uitgewisseld met het buitenmembraan.
De Intermitterende Hypoxie-Hyperoxie Therapie (IHHT) is een ademhalingstherapeutische modaliteit om de inspanningsprestaties te verbeteren via gecontroleerde conditionering van de mitochondriën. Het doel van deze studie is om het therapeutische effect van IHHT op functioneel en symptomatisch herstel te onderzoeken bij patiënten met Post COVID-syndroom (PCS).
Er werd een prospectieve, gecontroleerde, interventionele studie met open behandeling uitgevoerd bij patiënten met Post-COVID die waren opgenomen in een klinisch revalidatieprogramma. Patiënten werden niet-gerandomiseerd toegewezen om IHHT te ontvangen naast het gestandaardiseerd revalidatieprogramma (IHHT-groep) of alleen standaardrevalidatie (controlegroep). De IHHT-groep ontving sessies onder toezicht van intermitterende hypoxische (10-12% O 2) en hyperoxische (30-35% O 2) ademhaling drie keer per week gedurende de revalidatieperiode.
Het primaire eindpunt was een verbeterde loopafstand in een 6-min looptest (6MWT) tussen de onderzoeksgroepen.
Secundaire eindpunten waren verandering in trapklimvermogen, dyspneu (Borg dyspneu Scale), vermoeidheidsbeoordelingsschaal (FAS) en verandering in gezondheidsgerelateerde kwaliteit van leven (HRQoL) beoordeeld door middel van de patiënt globale beoordeling (PGA), EQ-5D analoge schaal en de MEDIAN Corona Recovery Score (MCRS). Verdere beoordelingen waren onder andere maximale handgreepkracht, negen-gaten-knijper-test, getimed up-and-go, ademhalingsfunctie en functionele ambulatiecategorie (FAC), serumanalyses en veiligheid van de interventie. [21]
Resultaten: In totaal werden 145 patiënten geïncludeerd in het onderzoek (74% vrouw, gemiddelde leeftijd 53 ± 12 jaar) en toegewezen aan IHHT
(n = 70) of standaardbehandeling (n = 75). De 6MWT-afstand verbeterde 2,8-voudig in de IHHT-groep vergeleken met de controlegroep (91,7 ± 50,1).
(91,7 ± 50,1 m vs. 32,6 ± 54,2 m, ANCOVA p < 0,001). Het trapklimvermogen verbeterde 3,7-voudig in de IHHT-groep vergeleken met
controles (-1,91 ± 2,23 s vs. -0,51 ± 1,93 s, p < 0,001). Secundaire eindpunten voor dyspneu, vermoeidheid en HRQoL (PGA, EQ-5D en EQ-5D, p <0,001MCRS) waren significant verbeterd in de IHHT-groep in vergelijking met controlegroep. De IHHT-groep vertoonde een significante daling in bloeddruk, hartslag en stijging van het hemoglobinegehalte dat niet werd waargenomen in de controlegroep. Er werden geen bijwerkingen waargenomen. [22]
Conclusie: Respiratoire behandeling met IHHT in aanvulling op een multidisciplinair revalidatieprogramma verbetert de functionele capaciteit, symptomatische status en kwaliteit van leven bij patiënten met invaliderende Post COVID. Het is aangetoond dat IHHT veilig is, goed te verdragen en kan worden geïntegreerd in een klinisch revalidatieprogramma om de uitkomst bij Post COVID te verbeteren.
IHHT is niet dé oplossing van PCS maar een onderdeel van de oplossing!
Mitochondriale disfunctie kan echter ook een gevolg zijn van verhoogde oxidatieve stress, immuundisregulatie of verhoogde ontsteking. Daarom moet de behandeling van PCS worden aangevuld met orthomoleculaire interventies op het gebied van deze mogelijke oorzaken.
Wat doet Finesse Medical Center
Zoals gezegd is het Post-Covid Syndroom complex en delicaat. De aanpak van de aandoening richt zich met name op het verbeteren van de mitochondriën. Daarnaast is het belangrijk dat ook de processen binnen de mitochondriën goed verlopen. Dit is een integraal onderdeel van de behandeling!.
Covid-Sars-2 richt direct en indirect schade aan, aan darmen en organen. Uitgebreid bloedonderzoek en ontlastingsonderzoek is hierbij onontbeerlijk. Meten = weten! Hierbij is wel heel belangrijk dat de juiste bepalingen worden gedaan, zoals zink, cortisol, B-vitamines, DHEAS, vitamine D, CRP (naast het reguliere bloedonderzoek) en bij de darmen vooral pH, gisten, schimmels, parasieten, ontstekingswaarden en Leaky Gut etc.
Aan de hand van alle uitslagen wordt een specifiek behandelplan opgesteld.
Dit behandelplan is veelomvattend: naast het herstel van aangedane mitochondriën: voeding, aanvullen van aangetoonde tekorten, verbeteren van de weerstand en het bestrijden van ontstekingsreacties en actieve virussen, herstel van disfunctie van darmen en organen.
Finesse Medical Center voert sinds april 2024 de OxyFin® behandelingen uit. De resultaten zijn opzienbarend. Patiënten knappen binnen enkele weken op, krijgen weer energie, concentratie, brainfog verdwijnt en PEM wordt steeds minder.
Conclusie
De constellatie van symptomen en stoornissen in het spectrum van PCS hebben een significante negatieve invloed op de individuele functionele status en kwaliteit van leven. En zijn in significante gevallen zelfs invaliderend. Gezien de hoge incidentie en prevalentie na acute infectie en/of vaccinatie is PCS een aandoening met een aanzienlijke impact op de maatschappij en de gezondheidszorg.
Er komt steeds meer wetenschappelijk bewijs naar de (langetermijn) effecten van de Covid-vaccinatie. Gelukkig ontstaan er steeds minder virulente SARS-CoV-2-stammen, is de relatieve impact minder ziekmakend. Dat neemt niet weg dat er nog steeds een wereldwijd enorme populatie patiënten zijn die dagelijks te kampen hebben met de alles beperkende gevolgen van PCS. Reden te meer om te pleiten voor een betere samenwerking, nationaal en internationaal!
IHHT is bij de behandeling een belangrijke factor, maar zorg voor de bijbehorende factoren is daarbij een voorwaarde voor goed herstel van Post-Covid patiënten.
Referenties
- https://www.umcutrecht.nl/nieuws/umc-utrecht-leidt-onderzoek-naar-long-covid
- WHO: World Health Statistics 2024
- Lam, M.H.; Wing, Y.K.; Yu, M.W.; Leung, C.M.; Ma, R.C.; Kong, A.P.; So, W.Y.; Fong, S.Y.; Lam, S.P. Mental morbidities and chronic fatigue in severe acute respiratory syndrome survivors: Long-term follow-up. Arch. Intern. Med. 2009, 169, 2142–2147.
- Lee, S.H.; Shin, H.S.; Park, H.Y.; Kim, J.L.; Lee, J.J.; Lee, H.; Won, S.D.; Han, W. Depression as a Mediator of Chronic Fatigue and Post-Traumatic Stress Symptoms in Middle East Respiratory Syndrome Survivors. Psychiatry Investig. 2019, 16, 59–64.
- Moldofsky, H.; Patcai, J. Chronic widespread musculoskeletal pain, fatigue, depression and disordered sleep in chronic post-SARS syndrome; a case-controlled study. BMC Neurol. 2011, 11, 37.
- Fukuda, K.; Straus, S.E.; Hickie, I.; Sharpe, M.C.; Dobbins, J.G.; Komaroff, A.; International Chronic Fatigue Syndrome Study Group. The chronic fatigue syndrome: A comprehensive approach to its definition and study. Ann. Intern. Med. 1994, 121, 953–959.
- Proal, A.D.; VanElzakker, M.B. Long COVID or Post-acute Sequelae of COVID-19 (PASC): An Overview of Biological Factors That May Contribute to Persistent Symptoms. Front. Microbiol. 2021, 12, 698169.
- Nederlandse Federatie van Universitair medische centra
- Tsilingiris, D.; Vallianou, N.G.; Karampela, I.; Christodoulatos, G.S.; Papavasileiou, G.; Petropoulou, D.; Magkos, F.; Dalamaga, M., Laboratory Findings and Biomarkers in Long COVID: What Do We Know So Far? Insights into Epidemiology, Pathogenesis, Therapeutic Perspectives and Challenges. Int. J. Mol. Sci. 2023, 24, 10458. https://doi.org/10.3390/ijms241310458
- Montazersaheb, S.; Hosseiniyan Khatibi, S.M.; Hejazi, M.S.; Tarhriz, V.; Farjami, A.; Ghasemian Sorbeni, F.; Farahzadi, R.; Ghasemnejad, T. COVID-19 infection: An overview on cytokine storm and related interventions. Virol. J. 2022, 19, 92.
- Stein, S.R.; Ramelli, S.C.; Grazioli, A.; Chung, J.Y.; Singh, M.; Yinda, C.K.; Winkler, C.W.; Sun, J.; Dickey, J.M.; Ylaya, K.; et al. SARS-CoV-2 infection and persistence in the human body and brain at autopsy. Nature 2022, 612, 758–763.
- Banko, A.; Miljanovic, D.; Cirkovic, A. Systematic review with meta-analysis of active herpesvirus infections in patients with COVID-19: Old players on the new field. Int. J. Infect. Dis. 2023, 130, 108–125.
- Kruger, A.; Vlok, M.; Turner, S.; Venter, C.; Laubscher, G.J.; Kell, D.B.; Pretorius, E. Proteomics of fibrin amyloid microclots in long COVID/post-acute sequelae of COVID-19 (PASC) shows many entrapped pro-inflammatory molecules that may also contribute to a failed fibrinolytic system. Cardiovasc. Diabetol. 2022, 21, 190.
- Captur, G.; Moon, J.C.; Topriceanu, C.C.; Joy, G.; Swadling, L.; Hallqvist, J.; Doykov, I.; Patel, N.; Spiewak, J.; Baldwin, T.; et al. Plasma proteomic signature predicts who will get persistent symptoms following SARS-CoV-2 infection. EBioMedicine 2022, 85, 104293.
- Guntur, V.P.; Nemkov, T.; de Boer, E.; Mohning, M.P.; Baraghoshi, D.; Cendali, F.I.; San-Millán, I.; Petrache, I.; D’Alessandro, A. Signatures of Mitochondrial Dysfunction and Impaired Fatty Acid Metabolism in Plasma of Patients with Post-Acute Sequelae of COVID-19 (PASC). Metabolites 2022, 12, 1026.
- Zhang, D.; Zhou, Y.; Ma, Y.; Chen, P.; Tang, J.; Yang, B.; Li, H.; Liang, M.; Xue, Y.; Liu, Y.; et al. Gut Microbiota Dysbiosis Correlates with Long COVID-19 at One-Year After Discharge. J. Korean Med. Sci. 2023, 38, e120.
- Apple, A.C.; Oddi, A.; Peluso, M.J.; Asken, B.M.; Henrich, T.J.; Kelly, J.D.; Pleasure, S.J.; Deeks, S.G.; Allen, I.E.; Martin, J.N.; et al. Risk factors and abnormal cerebrospinal fluid associate with cognitive symptoms after mild COVID-19. Ann. Clin. Transl. Neurol. 2022, 9, 221–226.
- Magalhães J, Falcão-Pires I, Gonçalves IO, Lumini-Oliveira J, Marques-Aleixo I, Dos Passos E, Rocha-Rodrigues S, Machado NG, Moreira AC, Miranda-Silva D, Moura C, Leite-Moreira AF, Oliveira PJ, Torrella JR, Ascensão A. Synergistic impact of endurance training and intermittent hypobaric hypoxia on cardiac function and mitochondrial energetic and signaling. Int J Cardiol. 2013;168(6):5363-71. doi: 10.1016/j.ijcard.2013.08.001. Cited in PubMed; PMID 24012275.
- Gangwar et. al. 2020, Intermittent hypoxia modulates redox homeostasis, lipid metabolism associated inflammatory processes and redox post-translational modifications: Benefits at high altitude https://www.researchgate.net/figure/IHT-modulates-the-trinity-of-lipid-metabolism-redox-homeostasis-and-inflammation_fig6_341347786
- Shafieesabet et. al., 2023 Treatment effect of respiratory therapy with intermittent hypoxic-hyperoxic training (IHHT) on functional capacity in patients with post COVID19 conditions: a controlled treatment trial) (https://academic.oup.com/eurheartj/article/44/Supplement_2/ehad655.2594/7391009,
- Wolfram Doehner, Azadeh Fischer, Banafsheh Alimi, Jasmin Muhar, Jochen Springer, Christoph Altmann, Per Otto Schueller Intermittent Hypoxic–Hyperoxic Training During Inpatient Rehabilitation Improves Exercise Capacity and Functional Outcome in Patients With Long Covid: Results of a Controlled Clinical Pilot Trial 781 Journal of Cachexia, Sarcopenia and Muscle, 2024; 15:2781–2791 https://doi.org/10.1002/jcsm.13628
- A. Shafieesabet, B. Alimi, J. Muhar, P.O. Schueller, W. Doehner, Treatment effect of respiratory therapy with intermittent hypoxic-hyperoxic training (IHHT) on functional capacity in patients with post COVID19 conditions: a controlled treatment trial, European Heart Journal (2023) 44 (Suppl 2)
- Portnichenko VI, Nosar’ VI, Portnichenko AG, Drevitskaia TI, Sidorenko AM, Man’kovskaia IN. [Phase changes in energy metabolism during periodic hypoxia]. Fiziol Zh. 2012;58(4):3-12. Cited in PubMed; PMID 22946319.
- Mankovska IM, Gavenauskas BL, Nosar VI, Nazarenko AІ, Rozova KV, Bratus LV. Mechanisms of muscle tissue adaptation to load hypoxia under intermittent hypoxia. Sports medicine. 2005;1:3-11 [Ukrainian].
- Bolisetty S, Jaimes EA. Mitochondria and reactive oxygen species: physiology and pathophysiology. Int J Mol Sci. 2013;14(3):6306-44. doi: 10.3390/ijms14036306. Cited in PubMed; PMID 23528859.
- Valentina Trapani, Andrea Rosanoff, Shadi Baniasadi, Mario Barbagallo, Sara Castiglioni, Fernando Guerrero-Romero, Stefano Iotti, André Mazur, Oliver Micke, Guitti Pourdowlat, Giuliana Scarpati, Federica I Wolf, Jeanette A Maier,The relevance of magnesium homeostasis in COVID-19, Eur J Nutr. 2022 Mar;61(2):625-636. doi: 10.1007/s00394-021-02704-y. Epub 2021 Oct 23.
- David Mantle, Iain Parry Hargreaves, Joan Carles Domingo, Mitochondrial Dysfunction and Coenzyme Q10 Supplementation in Post-Viral Fatigue Syndrome: An Overview Int J Mol Sci. 2024 Jan 1;25(1):574. doi: 10.3390/ijms25010574
- Karampela, I.; Vallianou, N.; Magkos, F.; Apovian, C.M.; Dalamaga, M. Obesity, Hypovitaminosis D, and COVID-19: The Bermuda Triangle in Public Health. Curr. Obes. Rep. 2022, 11, 116–125.
- di Filippo, L.; Frara, S.; Nannipieri, F.; Cotellessa, A.; Locatelli, M.; Rovere Querini, P.; Giustina, A. Low vitamin D levels are associated with Long COVID syndrome in COVID-19 survivors. J. Clin. Endocrinol. Metab. 2023.
- Mohamed Hussein, A.A.R.; Galal, I.; Amin, M.T.; Moshnib, A.A.; Makhlouf, N.A.; Makhlouf, H.A.; Abd-Elaal, H.K.; Kholief, K.M.S.; Abdel Tawab, D.A.; Kamal Eldin, K.A.; et al. Prevalence of vitamin D deficiency among patients attending Post COVID-19 follow-up clinic: A cross-sectional study. Eur. Rev. Med. Pharmacol. Sci. 2022, 26, 3038–3045.
- Lun-Wu Hung, Mei-Yuan Liu, Tsung Yu, Kuo-Chuan Hung, Ya-Wen Tsai, Chih-Cheng Lai, Jheng-Yan Wu, Zinc Deficiency and Post-acute Outcomes in Patients With COVID-19: A Six-Month Retrospective Cohort Analysis of 3,726 Patients, Cureus . 2024 Oct 16;16(10):e71609. doi: 10.7759/cureus.71609. eCollection 2024 Oct.
- Fakhri Yosifova Aneva, et al., 2019, The Neuroprotective Effects of Astaxanthin: Therapeutic Targets and Clinical Perspective, Molecules 2019, 24(14), 2640; https://doi.org/10.3390/molecules24142640
- Su, Y.; Yuan, D.; Chen, D.G.; Ng, R.H.; Wang, K.; Choi, J.; Li, S.; Hong, S.; Zhang, R.; Xie, J.; et al. Multiple early factors anticipate post-acute COVID-19 sequelae. Cell 2022, 185, 881–895.e820.
- Klein, J.;Wood, J.; Jaycox, J.; Lu, P.; Dhodapkar, R.M.; Gehlhausen, J.R.; Tabachnikova, A.; Tabacof, L.; Malik, A.A.; Kamath, K.; et al. Distinguishing features of Long COVID identified through immune profiling. MedRxiv 2022.
- Katiukhin VN, Ochirova AT. [Change of sensitivity to hypotensive treatment under the effect of intermittent altitude hypoxia]. Vrach Delo 1979; 1: 32–5.
- Phetsouphanh, C.; Darley, D.R.; Wilson, D.B.; Howe, A.; Munier, C.M.L.; Patel, S.K.; Juno, J.A.; Burrell, L.M.; Kent, S.J.; Dore, G.J.; et al. Immunological dysfunction persists for 8 months following initial mild-to-moderate SARS-CoV-2 infection. Nat. Immunol. 2022, 23, 210–216.
- Zollner, A.; Koch, R.; Jukic, A.; Pfister, A.; Meyer, M.; Rössler, A.; Kimpel, J.; Adolph, T.E.; Tilg, H. Postacute COVID-19 is Characterized by Gut Viral Antigen Persistence in Inflammatory Bowel Diseases. Gastroenterology 2022, 163, 495–506.e498.
- Yonker, L.M.; Gilboa, T.; Ogata, A.F.; Senussi, Y.; Lazarovits, R.; Boribong, B.P.; Bartsch, Y.C.; Loiselle, M.; Rivas, M.N.; Porritt, R.A.; et al. Multisystem inflammatory syndrome in children is driven by zonulin-dependent loss of gut mucosal barrier. J. Clin. Investig. 2021, 131.
- Ruiz-Pablos, M.; Paiva, B.; Montero-Mateo, R.; Garcia, N.; Zabaleta, A. Epstein-Barr Virus and the Origin of Myalgic Encephalomyelitis or Chronic Fatigue Syndrome. Front. Immunol. 2021, 12, 656797
- Bastard, P.; Gervais, A.; Le Voyer, T.; Rosain, J.; Philippot, Q.; Manry, J.; Michailidis, E.; Hoffmann, H.H.; Eto, S.; Garcia-Prat, M.; et al. Autoantibodies neutralizing type I IFNs are present in ~4% of uninfected individuals over 70 years old and account for ~20% of COVID-19 deaths. Sci. Immunol. 2021, 6, eabl4340.
- Turner, S.; Khan, M.A.; Putrino, D.; Woodcock, A.; Kell, D.B.; Pretorius, E. Long COVID: Pathophysiological factors and abnormalities of coagulation. Trends Endocrinol. Metab. 2023, 34, 321–344.
- Haffke, M.; Freitag, H.; Rudolf, G.; Seifert, M.; Doehner,W.; Scherbakov, N.; Hanitsch, L.;Wittke, K.; Bauer, S.; Konietschke, F.; et al. Endothelial dysfunction and altered endothelial biomarkers in patients with post-COVID-19 syndrome and chronic fatigue syndrome (ME/CFS). J. Transl. Med. 2022, 20, 138.
- Yong, S.J.; Halim, A.; Halim, M.; Liu, S.; Aljeldah, M.; Al Shammari, B.R.; Alwarthan, S.; Alhajri, M.; Alawfi, A.; Alshengeti, A.; et al. Inflammatory and vascular biomarkers in post-COVID-19 syndrome: A systematic review and meta-analysis of over 20 biomarkers. Rev. Med. Virol. 2023, 33, e2424.
- Peluso, M.J.; Sans, H.M.; Forman, C.A.; Nylander, A.N.; Ho, H.E.; Lu, S.; Goldberg, S.A.; Hoh, R.; Tai, V.; Munter, S.E.; et al. Plasma Markers of Neurologic Injury and Inflammation in People with Self-Reported Neurologic Postacute Sequelae of SARS-CoV-2 Infection. Neurol. (R) Neuroimmunol. Neuroinflamm. 2022, 9, e200003.
- Littlefield, K.M.;Watson, R.O.; Schneider, J.M.; Neff, C.P.; Yamada, E.; Zhang, M.; Campbell, T.B.; Falta, M.T.; Jolley, S.E.; Fontenot, A.P.; et al. SARS-CoV-2-specific T cells associate with inflammation and reduced lung function in pulmonary post-acute sequalae of SARS-CoV-2. PLoS Pathog. 2022, 18, e1010359.
- Apostolo, D.; D’Onghia, D.; Tonello, S.; Minisini, R.; Baricich, A.; Gramaglia, C.; Patrucco, F.; Zeppegno, P.; Acquaviva, A.; Balbo, P.E.; et al. Decreased Gas6 and sAxl Plasma Levels Are Associated with Hair Loss in COVID-19 Survivors. Int. J. Mol. Sci. 2023, 24, 6257.
- Goda N, Kanai M. Hypoxia-inducible factors and their roles in energy metabolism. Int J Hematol. 2012;95(5):457-63. doi: 10.1007/s12185-012-1069-y. Cited in PubMed; PMID 22535382.
- Weidemann A, Johnson RS. Biology of HIF-1alpha. Cell Death Differ. 2008;15(4):621-7. doi: 10.1038/cdd.2008.12. Cited in PubMed; PMID 18259201.

