Metabool syndroom (insulineresistentiesyndroom, syndroom X, dysmetabool syndroom) is geen ziekte, maar een complex van met elkaar samenhangende (metabole) risicofactoren voor diabetes type 2 en hart- en vaatziekten.
De diagnose metabool syndroom wordt gesteld aan de hand van vijf criteria (zie hieronder); na jarenlange discussie is hierover internationale consensus bereikt. De belangrijkste kenmerken (risicofactoren) van metabool syndroom zijn een overmaat aan vetweefsel in de buikstreek (abdominale, viscerale obesitas), atherogene dyslipidemie (verhoogde bloedspiegels van triglyceriden, apolipoproteïne-B en compacte [atherogene] LDL-cholesteroldeeltjes en een verlaagde HDL-cholesterolspiegel), een verhoogde bloeddruk en verhoogde (nuchtere) bloedglucosespiegel. Andere (ongunstige) kenmerken van metabool syndroom zijn een chronische laaggradige ontstekingsactiviteit (met verhoogde spiegels van ontstekingsmediatoren zoals C-reactief proteïne, TNF-α, IL-1, IL-6), verhoogde oxidatieve stress, endotheeldisfunctie en een protrombotische toestand (toegenomen stollingsneiging door een snellere klontering van bloedplaatjes en verhoogde spiegels van onder meer PAI-1 [plasma plasminogen activator inhibitor–1] en fibrinogeen). Insulineresistentie en abdominale obesitas zijn waarschijnlijk de belangrijkste oorzaken van het clusteren van deze risicofactoren.
De diagnose metabool syndroom wordt gesteld als minimaal 3 van de 5 criteria aanwezig zijn:
- Abdominale obesitas: overmaat buikvet met taille omvang >88 cm bij vrouwen; >102 cm bij mannen.
- Triglyceriden ≥150 mg/dl (1,7 mmol/l) of medicamenteuze behandeling van hypertriglyceridemie.
- HDL-cholesterol <50 mg/dl (1,3 mmol/l) bij vrouwen; <40 mg/dl (1,0 mmol/l) bij mannen of medicamenteuze behandeling van een laag HDL-cholesterol.
- Bloeddruk, systolisch ≥130 mm Hg en/of diastolisch ≥85 mm Hg of medicamenteuze behandeling van hypertensie.
- Nuchtere bloedglucosespiegel ≥100 mg/dl (5,5 mmol/l) of medicamenteuze behandeling van diabetes type 2.
Gevolgen van Metabool Syndroom
Mensen met metabool syndroom (3-5 criteria) hebben twee keer zoveel kans om in de komende 5 tot 10 jaar hart- en/of vaatziekten te ontwikkelen en vijf keer zoveel kans om diabetes type 2 te krijgen vergeleken met gezonde mensen. Uit een retrospectieve analyse van de West of Scotland Study blijkt zelfs dat mannen die aan 4 of 5 criteria van metabool syndroom voldoen, 25 keer zoveel kans hebben op diabetes en 4 keer zoveel kans op een cardiovasculaire aandoening vergeleken met controlegroepen. Bovendien is metabool syndroom geassocieerd met versnelde veroudering en een toegenomen kans op andere (chronische) klachten en (degeneratieve) aandoeningen (zie hieronder). Uit een onderzoek uit 2011 komt naar voren dat mensen met metabool syndroom meer psychische, lichamelijke en psychosociale problemen hebben en een lagere gezondheidsgerelateerde kwaliteit van leven ervaren dan mensen zonder metabool syndroom. Of metabool syndroom hiervan de oorzaak is, moet nader worden onderzocht. Het signaleren en behandelen van metabool syndroom biedt in elk geval een uitstekende mogelijkheid om veroudering tegen te gaan en leeftijdsgerelateerde) ziekten te voorkomen en te vertragen.
De kans op metabool syndroom neemt toe met het ouder worden. De prevalentie van metabool syndroom in Nederland (2020) bedraagt 18% van de werkende mannen en 11% van de werkende vrouwen. De prevalentie verschilt echter sterk per leeftijdsgroep en neemt van ongeveer twee tot drie procent onder 18-24-jarigen toe tot wel 26 procent bij vrouwen en 33 procent bij mannen van 60-64 jaar Dit komt neer op meer dan 2 miljoen Nederlandse volwassenen met metabool syndroom.
Klachten en aandoeningen geassocieerd met metabool syndroom:
- diabetes type 2
- hart- en vaatziekten (coronaire aandoeningen, hartfalen, myocardinfarct, beroerte, perifere vasculaire aandoeningen)
- obesitas
- osteoporose
- osteoartritis
- jicht
- cognitieve achteruitgang
- ziekte van Alzheimer
- sub- en infertiliteit
- seksuele disfunctie (erectiestoornis, laag libido)
- chronische vermoeidheid
- chronische stress
- depressie
- kanker (borst, dikke darm, pancreas, prostaat, endometrium)
- slaapapneu en snurken
- (cholesterol)galstenen
- chronische nierziekten
- polycysteus ovariumsyndroom
- niet-alcoholische leververvetting (NAFLD)
- steatohepatitis (NASH)
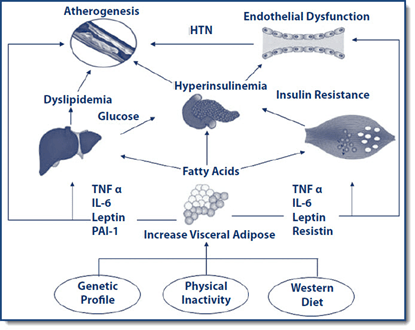
Figuur 1. Pathofysiologie van metabool syndroom(1)HTN = hypertensie, IL = interleukine, PAI=plasminogen-activator inhibitor-1, TNF= tumor necrosis factorFactoren die metabool syndroom bevorderen
Metabool syndroom heeft een sterke genetische component. Sommige mensen hebben vergeleken met anderen een lagere gevoeligheid voor insuline (de mate waarin insuline de bloedglucosespiegel kan verlagen) en/of bezitten genen die predisponeren voor overgewicht en obesitas. Een laag geboortegewicht of een behandeling voor kanker op kinderleeftijd predisponeert ook voor metabool syndroom. Echter, meer dan de helft van de kans op metabool syndroom is te wijten aan een verkeerd voedingspatroon en andere leefstijlgerelateerde factoren. Verschillende combinaties van teveel (geraffineerde) koolhydraten, teveel verzadigde vetten en transvetten, teveel calorieën, onvoldoende groenten en fruit, teveel koffie en/of alcohol, onvoldoende inname van voedingsvezels en essentiële voedingsstoffen, roken, een zittende leefstijl, slaaptekort en chronische stress kunnen de pathofysiologische processen initiëren en versnellen.(1) Metabool syndroom kan worden bevorderd door (bijkomende) psychische en lichamelijke ziekten (waaronder depressie, cystische fibrose, chronische ontstekingsziekten zoals reuma) en door het gebruik van bepaalde medicijnen (antidepressiva, antipsychotica, anticonceptiepil, corticosteroïden, proteaseremmers).(9)
Pathofysiologie van metabool syndroom
De pathofysiologie van metabool syndroom is complex en is slechts ten dele opgehelderd. Twee elkaar versterkende factoren, insulineresistentie en abdominale obesitas, verklaren voor een groot deel de verschijnselen van metabool syndroom.(1,4,5,12)
Insulineresistentie
Insuline wordt in bètacellen van de alvleesklier geproduceerd en in de circulatie gebracht door de alvleesklier als de bloedglucosespiegel te hoog dreigt te worden, zoals na het eten van koolhydraten. Het zet insulinegevoelige cellen (spier-, lever- en vetcellen) als het ware open voor glucose door zich te binden aan insulinereceptoren. Insulinegevoelige weefsels slaan overtollig glucose op voor later gebruik in de vorm van glycogeen en (vooral) vetten. Als de bloedglucosespiegel te laag dreigt te worden dan zorgt glucagon dat de lever voldoende glucose afgeeft aan het bloed. Deze glucose is afkomstig uit de glycogeenvoorraad of wordt gesynthetiseerd uit eiwitten, lactaat of glycerol (gluconeogenese). Idealiter schommelt de bloedglucosespiegel weinig en is de insuline-afgifte niet hoger dan strikt noodzakelijk.
Insulineresistentie houdt in dat insulinegevoelige weefsels (met name lever en spieren) minder goed op insuline reageren. Om te zorgen dat de cellen toch glucose opnemen geeft de alvleesklier meer insuline af (hyperinsulinemie). Dit compensatiemechanisme waarborgt een normale bloedsuikerspiegel. Helaas houden insulineresistentie en de daarop volgende insulinestijging elkaar in stand en verergert de situatie gaandeweg. Diabetes type 2 ontstaat bij ongeveer 20% van de mensen met insulineresistentie. Door ontstekingen, oxidatieve beschadigingen en uitputting kan de insulineproductie door bètacellen afnemen waardoor onvoldoende insuline beschikbaar is om de bloedglucosespiegel onder controle te houden. Bij 80% van de mensen komt het niet zo ver en blijft het evenwicht tussen insulineresistentie en hyperinsulinemie dusdanig dat de glucosespiegel binnen de normale grenzen blijft. Vaak schommelt de bloedglucosespiegel meer dan normaal; op termijn kan de nuchtere glucosespiegel geleidelijk stijgen en/of stijgt de glucosespiegel na het eten van koolhydraten sterker dan normaal (postprandiale hyperglycemie). Deze (milde) hyperglycemie draagt bij aan aderverkalking, onder meer door de vorming van AGE’s (advanced glycation end products).
Insulineresistentie kan het (directe) gevolg zijn van erfelijke aanleg (verminderde insulinewerking door mutaties van de insulinereceptor of autoantilichamen tegen de insulinereceptor), gebrek aan lichaamsbeweging, ongezonde voeding (veel geraffineerde koolhydraten en verzadigde vetten, tekort aan essentiële voedingsstoffen) en verhoogde spiegels van ontstekingsbevorderende cytokines waaronder TNF-α en IL-6 (door veroudering, chronische ontstekingsziekten of abdominale obesitas). Insulineresistentie kan abdominale obesitas bevorderen; het metabool actieve vetweefsel in de buikstreek (visceraal vet) is minder snel insulineresistent dan lever en spieren en neemt daardoor naar verhouding meer glucose dan normaal uit het bloed op. Normaliter zijn de spieren verantwoordelijk voor 80% van de insulinegemedieerde glucoseopname.
Abdominale obesitas
Erfelijke aanleg voor overgewicht, gebrek aan lichaamsbeweging en overmatig (en ongezond) eten kunnen leiden tot abdominale obesitas en overgewicht. Bij veel mensen is abdominale obesitas eerder oorzaak dan gevolg van metabool syndroom (zie figuur 1).
Abdominaal vetweefsel fungeert als een endocrien orgaan en beïnvloedt andere organen door de afgifte van adipokines (leptine, resistine, adiponectine, plasminogen-activator inhibitor-1), ontstekingsbevorderende cytokines (IL-1α, IL-1β, IL-6, TNF-α) en niet-veresterde vetzuren. Adipokines, pro-inflammatoire cytokines en vrije vetzuren induceren insulineresistentie in spieren en lever, wat leidt tot (toename van) hyperinsulinemie en hyperglycemie. Hyperinsulinemie draagt bij aan endotheeldysfunctie en atherogenese. Vrije vetzuren die worden opgenomen door de lever hebben een ongunstige invloed op de glucose- en vetstofwisseling in de lever: er treedt leververvetting op, de lever produceert meer glucose als gevolg van insulineresistentie (hetgeen bijdraagt aan hyperglycemie), de HDL-cholesterolspiegel daalt en de spiegels van LDL-cholesterol, triglyceriden en apolipoproteïne-B stijgen.
De kans op hart- en vaatziekten neemt toe door chronische laaggradige ontstekingen, toename van oxidatieve stress en endotheeldysfunctie. Insulineresistentie en hyperinsulinemie verhogen de bloeddruk onder meer door endotheeldysfunctie, verlaging van het intracellulaire magnesiumgehalte, verlaging van de natriumuitscheiding door de nieren en activering van het sympathische zenuwstelsel.
Behandeling van metabool syndroom
Aangezien metabool syndroom een multifactoriële aandoening is, dient de behandeling ervan op verschillende pijlers te berusten.
Sport en beweging
Gebrek aan lichaambeweging bevordert insulineresistentie, nog los van eventuele gewichtstoename door een dysbalans tussen energie-inname en energieverbruik. Zittende bezigheden zijn overigens iets minder ongezond als iemand geregeld opstaat en wat beweging neemt.(13) Professor Blair van de universiteit van Denton noemt metabool syndroom het ‘physical inactivity syndrome’, aangezien alle vijf criteria van metabool syndroom gecorreleerd zijn aan lichamelijke inactiviteit.(14) Meer beweging verbetert de lichamelijke conditie significant en verlaagt de sterftekans.(14,15) Mannen met diabetes type 2 (en metabool syndroom) hebben bij een slechte lichamelijke conditie zes tot zeven keer meer kans te overlijden aan hart- en vaatziekten dan bij een goede conditie.(14)
Bij obese kinderen, die gedurende 8 weken drie uur per week onder begeleiding trainden (maar niet op dieet waren), verbeterden insulinegevoeligheid en conditie significant zonder veranderingen in de lichaamssamenstelling.(16) Regelmatig bewegen is een voorwaarde voor een blijvend effect op de insulinegevoeligheid. De aanbeveling is om (liefst) elke dag ten minste gedurende dertig minuten te fietsen of stevig door te wandelen.
Afvallen en verhogen vetvrije massa
Afvallen verbetert insulinegevoeligheid en bloedlipiden bij mensen met metabool syndroom en overgewicht of obesitas. Overigens, een normaal lichaamsgewicht is niet per definitie gezond. Mensen met een normaal lichaamsgewicht kunnen een te hoog vetpercentage hebben (>26% bij mannen, >38% bij vrouwen); zij hebben net zoals mensen met overgewicht een grotere kans op metabool syndroom door verhoogde spiegels van bloedlipiden en ontstekingsmediatoren.(17) Een te hoog vetpercentage bij een normaal lichaamsgewicht wordt ‘normal weight obesity’ (NWO) genoemd.(18)
Rust, ontspanning en afzien van roken
Voldoende slaap en ontspanning helpen metabool syndroom terug te dringen. Chronische stress verhoogt de cortisolspiegel, wat leidt tot verhoging van de bloedglucosespiegel, insulineresistentie, hyperinsulinemie en toename van de ontstekingsactiviteit. Hyperinsulinemie activeert het sympathische zenuwstelsel en houdt stress in stand. Cortisol stimuleert vetopslag in de buikstreek en buikvet verhoogt de cortisolspiegel; beide dragen bij aan metabool syndroom. In een studie uit 2011 is aangetoond dat meditatie (twee keer daags 15 tot 20 minuten) helpt om psychische stress te verminderen en parameters van metabool syndroom te verbeteren; de onderzoekers zagen significante verbeteringen in stemming, lichaamsgewicht, diastolische bloeddruk, triglyceridenspiegel en endotheelfunctie.(19)
Roken is sterk af te raden. Roken bevordert insulineresistentie, verhoogt de triglyceridenspiegel, verlaagt de HDL-spiegel en zorgt voor kleinere (atherogene) LDL-deeltjes.(20) Daarnaast zijn bij rokers verhoogde serumspiegels van fibrinogeen (een stollingseiwit), C-reactief proteïne (een ontstekingseiwit) en homocysteïne gevonden, factoren die metabool syndroom en hart- en vaatziekten bevorderen.(21)
Eten volgens De Voedselzandloper.
Belangrijk is een volwaardige voeding met een lage glycemische index. Mensen met (aanleg voor) metabool syndroom hebben volwaardige voeding nodig met een lage glycemische index, dat wil zeggen (vezelrijke) voeding met complexe koolhydraten die relatief langzaam door het lichaam worden verteerd en de bloedglucosespiegel na het eten niet te snel laat stijgen.(22) Een eiwitrijk dieet is niet geschikt voor mensen met leverziekten (hepatitis, cirrose) of nierfalen; mensen met jicht dienen (rood) vlees als eiwitbron te mijden. Het soort vetten in de voeding is ook van belang. Enkelvoudig en meervoudig onverzadigde vetten (met name omega-3 vetzuren) beschermen tegen metabool syndroom, transvetten bevorderen daarentegen metabool syndroom.
Metabool syndroom versterkt de negatieve effecten van zout op de bloeddruk. Insuline bevordert de retentie van natrium; dit effect neemt toe bij hyperinsulinemie. Abdominale obesitas en verhoogde spiegels van leptine en TNF-α zijn ook geassocieerd met een verhoogde zoutgevoeligheid.(28-30) Een hoge zoutinname leidt daarom bij mensen met metabool syndroom tot een sterkere bloeddrukverhoging dan normaal.(31) Overigens kan zoutbeperking, onafhankelijk van metabool syndroom, al zorgen voor verlaging van de kans op hart- en vaatziekten met 25 procent.(32) Matig drinken is geassocieerd met een kleinere kans op metabool syndroom. Mannen die maximaal 40 gram alcohol per dag consumeren (4 standaardglazen) en vrouwen die maximaal 20 gram alcohol consumeren (2 standaardglazen) hebben respectievelijk 25% en 16% minder kans op metabool syndroom dan niet-drinkers.(33) Met het oog op negatieve effecten van alcohol (waaronder een verhoogde kans op hypertensie en kanker, waaronder borstkanker) adviseert de Gezondheidsraad volwassen mannen niet meer dan 2 standaardglazen alcohol per dag te drinken en volwassen vrouwen niet meer dan 1 standaardglas.
De voedingssupplementen van Biogena
Ondersteuning met kaneel
Kaneelextract (type A en type B oligomere proanthocyanidinen) heeft gunstige effecten op belangrijke parameters van metabool syndroom, waaronder insulinegevoeligheid, bloedglucose- en bloedlipidenspiegels, antioxidantstatus, ontstekingsactiviteit, bloeddruk en lichaamsgewicht.(34-36) Kaneel verbetert de insulinegevoeligheid ook bij mensen met een normale glucosetolerantie. Een enkele dosis kaneel van 5 gram zorgde bij gezonde vrijwilligers, die een orale glucosetolerantietest ondergingen, voor significante verlaging (vergeleken met placebo) van de postprandiale bloedglucose- en insulinespiegels.(34,37) Bij volwassenen met metabool syndroom, die gedurende 12 weken kaneelextract (500 mg/dag) innamen, daalden de nuchtere bloedglucosespiegel, de systolische bloeddruk en het percentage lichaamsvet significant; tevens verbeterde de antioxidantstatus significant vergeleken met de placebogroep.(34,38)
In verschillende studies met proefpersonen met diabetes type 2 resulteerde suppletie met kaneel(extract) in verbeteringen van de nuchtere en postprandiale bloedglucosespiegel, totaalcholesterol-, LDL-, HDL- en HbA1c-spiegels.(34) Een meta-analyse van acht placebogecontroleerde klinische studies concludeert dat kaneel (1-6 gram per dag) of (wateroplosbaar) kaneelextract (250-500 mg per dag) de nuchtere bloedglucosespiegel bij mensen met (pre)diabetes significant verlaagt met gemiddeld 0,5 mmol/l (5,8%).(39) De onderzoekers merken tevens op dat kaneel(extract) een even groot effect heeft op de nuchtere bloedglucosespiegel als het orale antidiabeticum metformine.
Ondersteuning met mariadistel
Mariadistel (Silybum marianum) is een kruid dat vooral bij leveraandoeningen wordt ingezet. Minder bekend is dat mariadistel ook een gunstige invloed heeft op de glucose- en vetstofwisseling bij mensen met metabool syndroom en/of diabetes type 2. Het extract van de zaden van mariadistel (silymarine, dat rijk is aan flavonolignanen) heeft een sterke ontstekingsremmende, antioxidatieve en celbeschermende werking, vermindert insulineresistentie en beschermt bètacellen van de pancreas tegen beschadiging en disfunctie door (vrije) radicalen en ontstekingsbevorderende cytokines.(40-43) In een placebogecontroleerde klinische studie zorgde suppletie met mariadistel-extract (600 mg/dag) voor significante verbetering van de glycemische controle (nuchtere bloedglucosespiegel, HbA1c), bloedlipiden (totaalcholesterol, LDL-cholesterol, triglyceriden, HDL-cholesterol) en leverenzymen (SGOT, SGPT) bij proefpersonen met diabetes type 2.(43)
B-vitaminen
B-vitaminen zijn essentieel voor de koolhydraat- en vetstofwisseling. Vitamine B6 is betrokken bij de synthese van insuline en glucagon. Een vitamine-B6-tekort bevordert glucose-intolerantie en vergroot de kans op metabool syndroom en diabetes type 2.(44) Foliumzuur, vitamine B6 en vitamine B12 helpen de homocysteïnespiegel laag te houden. Een verhoogde homocysteïnespiegel bevordert insulineresistentie en komt vaak voor bij mensen met metabool syndroom.(45,46) Een te hoog vitamine B6 vergroot de kans op Polyneuropathiëen. Controle van de bloedwaarde is hierbij heel belangrijk!
Niacine (vitamine B3) is heel geschikt voor de behandeling van dyslipidemie bij mensen met metabool syndroom.(47-49) Niacine (≤ 2 gram/dag) is het meest effectieve middel om de HDL-cholesterolspiegel te verhogen; tevens speelt niacine een rol bij verlaging van de spiegels van triglyceriden, LDL- en totaalcholesterol en zorgt het voor verschuiving van kleine, atherogene LDL-deeltjes naar grote, normale LDL-deeltjes.(49)
Ondersteuning met antioxidanten
Bij mensen met metabool syndroom zorgen insulineresistentie en dyslipidemie voor toename van oxidatieve stress en een groter verbruik van antioxidanten zoals vitamine C, vitamine E en carotenoïden.(50) Oxidatieve stress bevordert insulineresistentie en vergroot de kans op diabetes type 2 door oxidatieve beschadiging van insulineproducerende bètacellen.(51) De vicieuze cirkel kan worden doorbroken door suppletie met vitamine C en vitamine E en andere antioxidanten zoals alfaliponzuur en astaxanthine. Vitamine C is tevens betrokken bij de koolhydraat- en vetstofwisseling en de afbraak van cholesterol in galzouten; vitamine E remt de met metabool syndroom geassocieerde (niet-alcoholische) leververvetting.
Ondersteuning met vitamine D
Vitamine D reguleert de insulinesecretie en insulinewerking; een lage calcidiolspiegel is geassocieerd met insulineresistentie, hyperglycemie, hypertensie, hypertriglyceridemie, vetophoping in de buikstreek en een lage HDL-cholesterolspiegel. (52-54)
Ondersteuning met magnesium
Magnesium is essentieel voor de aanmaak en afgifte van insuline door de pancreas en de insulinegevoeligheid van lever-, spier- en vetweefsel.(55) Een verlaagde magnesiumstatus en magnesiuminname met de voeding is geassocieerd met insulineresistentie, verhoging van de ontstekingsmediator C-reactief proteïne (CRP), dyslipidemie en een grotere kans op metabool syndroom, diabetes type 2 en hypertensie.(55-57) Insulineresistentie en een magnesiumtekort versterken elkaar: bij insulineresistentie wordt magnesium niet goed in de cellen opgenomen en neemt de uitscheiding van magnesium toe; daling van de intracellulaire magnesiumspiegel bevordert insulineresistentie.(55) Experimentele en klinische studies laten zien dat verbetering van de magnesiumstatus leidt tot verhoging van de insulinegevoeligheid, verlaging van de triglyceridenspiegel, verhoging van de HDL-cholesterolspiegel, afname van de (laaggradige) ontstekingsactiviteit, verbetering van endotheelfunctie en vermindering van plaatjesaggregatie.(56-59) In een studie uit 2011 leidde magnesiumsuppletie (365 mg/dag), vergeleken met placebo, tot significante verlaging van de nuchtere bloedglucosespiegel en verbetering van de insulinegevoeligheid bij volwassenen met overgewicht en insulineresistentie. De proefpersonen hadden geen magnesiumtekort bij aanvang van de studie.(60)
Ondersteuning met chroom
Chroom is een belangrijk mineraal voor de glucose- en vetstofwisseling en helpt bij het onder controle houden van de eetlust. Het is onderdeel van de glucosetolerantie factor (GTF) dat nodig is voor een normale insulinewerking. Het is opmerkelijk dat de symptomen van een chroomtekort overeenkomen met die van metabool syndroom: een verhoogde nuchtere bloedglucosespiegel en triglyceridenspiegel, een verlaagde HDL-cholesterolspiegel, verhoogde bloeddruk en abdominale obesitas.(36) Bij metabool syndroom kan de chroomstatus verlaagd zijn door een toegenomen uitscheiding van chroom met de urine. Chroomsuppletie (200-1000 mcg/dag) verbetert de insulinegevoeligheid en glucosetolerantie bij mensen met metabool syndroom en/of diabetes type 2 en heeft tevens een gunstige invloed op de triglyceriden- en HDL-spiegel, het lichaamsgewicht en de lichaamssamenstelling (afname vetmassa, toename vetvrije massa).(36,61-63)
Ondersteuning met zink en selenium
Zink is essentieel voor de productie van insuline, heeft zelf een insuline-achtige activiteit en potentieert de werking van insuline.(64) Een zinktekort is geassocieerd met een verminderde glucosetolerantie, een te hoge triglyceriden- en cholesterolspiegel en een grotere kans op hypertensie, diabetes type 2 en hart- en vaatziekten. Onderzoekers vermoeden dat een zinktekort bijdraagt aan verhoging van de spiegels van de pro-inflammatoire cytokines TNF-α en IL-1 bij metabool syndroom.
Selenium verbetert de vetstofwisseling in de lever, beschermt LDL-cholesterol tegen oxidatie en gaat atherosclerose tegen. Bovendien heeft selenium een insuline-achtige werking en helpt het mineraal bij het verminderen van insulineresistentie en het normaliseren van de glucose- en insulinespiegel. In een onderzoek is bij gezonde jongvolwassenen een inverse associatie gevonden tussen de seleniuminname en de bloedspiegel van siaalzuur, een ontstekingsmediator die vaak verhoogd is bij mensen met metabool syndroom en diabetes type 2 en een voorspeller is van hart- en vaatziekten.(65) Dit suggereert dat selenium een ontstekingsremmende activiteit bezit. Zwangere vrouwen die door toename van insulineresistentie (en onvoldoende stijging van de insulineproductie) zwangerschapsdiabetes ontwikkelen, hebben gemiddeld een lagere inname van zink en selenium dan vrouwen zonder deze zwangerschapscomplicatie.(66)
Ondersteuning met kalium
Kalium ondersteunt de insulinesecretie door bètacellen en een verlaagde kaliumserumspiegel is geassocieerd met een verstoorde bloedglucoseregulatie en een grotere kans op diabetes type 2.(67) Daarnaast is kalium belangrijk voor het normaliseren van de bloeddruk, vooral bij een kaliumtekort of een verminderde uitscheiding van natrium (en een ongunstige natrium-kalium verhouding), zoals bij metabool syndroom. Stress verhoogt de kaliumbehoefte
Ondersteuning met psylliumvezels
Psylliumvezels hebben een gunstige invloed op de glucose- en vetstofwisseling, ontstekingsactiviteit en (systolische en diastolische) bloeddruk en zijn heel geschikt voor de preventie en (aanvullende) behandeling van metabool syndroom en diabetes type 2.(11,68) Psyllium vertraagt de opname van glucose uit het maag-darmkanaal na het eten van koolhydraten, zodat minder insuline nodig is om de bloedglucosespiegel in het gareel te houden; daarnaast verhoogt psyllium de insulinegevoeligheid van spierweefsel. Bij proefpersonen met diabetes type 2 daalden de postprandiale glucose- en insulinespiegels significant door het gebruik van psylliumvezels (bij de maaltijd). Daarnaast zorgen psylliumvezels (7-11 gram/dag) voor verlaging van de LDL-cholesterolspiegel en triglyceridenspiegel en verhoging van het gunstige HDL-cholesterol.(11) Een Indiase studie suggereert dat suppletie met psylliumvezels (7 gram/dag) bijna even effectief is bij hyperlipidemie als simvastatine (20 mg/dag).(69) Psylliumvezels remmen de reabsorptie van galzuren en bevorderen daarmee de uitscheiding van cholesterol; ook kunnen psylliumvezels de activiteit van het leverenzym 7α-hydroxylase verhogen, waardoor de omzetting van cholesterol in galzuren toeneemt. Psylliumvezels remmen de eetlust en helpen bij het afvallen.
Ondersteuning met visolie
Suppletie met langeketen omega-3 vetzuren (EPA, DHA) uit vette vis verbetert de insulinegevoeligheid en verkleint de kans op diabetes type 2 en hart- en vaatziekten bij mensen met metabool syndroom.(1,70-73) Visolie verlaagt de triglyceridenspiegel en het percentage compacte, atherogene LDL-deeltjes (zonder verlaging van de LDL-spiegel), vermindert chronische laaggradige ontsteking en oxidatieve stress, remt plaatjesaggregatie en verbetert de endotheelfunctie en bloeddruk.(1,70,74-76) DHA verhoogt de HDL-cholesterolspiegel.(70) De aanbeveling is om dagelijks (minimaal) 1 gram langeketen omega-3 vetzuren te consumeren (0,6-1,2% van de totale calorie-inname).(76)
Klik hier voor advies of voor het maken van een afspraak voor een gratis en vrijblijvend consult.
Referenties:
Potenza MV et al. The metabolic syndrome: definition, global impact, and pathophysiology. Nutr Clin Pract. 2009;24(5):560-577.
Alberti KG et al. Harmonizing the metabolic syndrome – a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. 2009;120:1640-1645.
Sattar N et al. Metabolic syndrome with and without C-reactive protein as a predictor of coronary heart disease and diabetes in the West of Scotland Coronary Prevention Study. Circulation 2003;108(4):414-419.
Miranda PJ et al. Metabolic syndrome: definition, pathophysiology, and mechanisms. Am Heart J. 2005;149(1):33-45.
Laclaustra M et al. Metabolic syndrome pathophysiology: the role of adipose tissue. Nutr Metab Cardiovasc Dis. 2007;17(2):125-39.
Nunn AV et al. Lifestyle-induced metabolic inflexibility and accelerated ageing syndrome: insulin resistance, friend or foe? Nutr Metab (Lond). 2009;6:16.
Tziallas D et al. The impact of the metabolic syndrome on health-related quality of life: A cross-sectional study in Greece. Eur J Cardiovasc Nurs. 2011 Mar 11. doi:10.1016/j.ejcnurse.2011.02.004.
Bos MB et al. De prevalentie van het metabool syndroom in Nederland: verhoogd risico op hart- en vaatziekten en diabetes mellitus type 2 bij een kwart van de personen jonger dan 60 jaar. Ned Tijdschr Geneeskd. 2007;151:2382-8.
Mendelson SD. Metabolic syndrome and psychiatric illness. Interactions, pathophysiology, assessment and treatment. Elsevier, 2008. ISBN: 978-0-12-374240-7.
Chen J et al. The metabolic syndrome and chronic kidney disease in U.S. adults. Ann Intern Med. 2004;140:167-174.
Giacosa A et al. The right fiber for the right disease. An update on the psyllium seed husk and the metabolic syndrome. J Clin Gastroenterol. 2010;44:S58–S60.
Sidiropoulos PI et al. Metabolic syndrome in rheumatic diseases: epidemiology, pathophysiology, and clinical implications. Arthritis Res Ther. 2008;10(3):207.
Bankoski A et al. Sedentary activity associated with metabolic syndrome independent of physical activity. Diabetes Care 2011;34:497-503.
Blair SN. Physical inactivity: a major public health problem. Nutrition Bulletin 2007;32:113-117.
Johnson JL et al. Exercise training amount and intensity effects on metabolic syndrome (from studies of a targeted risk reduction intervention through defined exercise). Am J Cardiol. 2007;100:1759 -1766.
Bell LM et al. Exercise alone reduces insulin resistance in obese children independently of changes in body composition. J Clin Endocrinol Metab. 2007;92:4230-4235.
De Lorenzo A et al. Normal-weight obese syndrome: early inflammation? Am J Clin Nutr. 2007;85:40-45.
Marques-Vidal P et al. Normal weight obesity: relationship with lipids, glycaemic status, liver enzymes and inflammation. Nutr Metab Cardiovasc Dis. 2010;20(9):669-75.
American Psychosomatic Society (APS) 69th Annual Scientific Meeting: Abstract 1639. Presented March 10, 2011.
Eliasson B et al. Insulin resistance in smokers and other long-term users of nicotine. In Contemporary Endocrinology: Insulin Resistance, G. Reaven and A. Laws, eds. Humana Press Inc., Totowa, NJ, 1999;121-136.
Bazzano LA et al. Relationship between cigarette smoking and novel risk factors for cardiovascular disease in the United States. Ann Intern Med. 2003;138:891-897.
Thomas DE et al. Low glycaemic index or low glycaemic load diets for overweight and obesity. Cochrane Database Syst Rev. 2007;(3):CD005105.
Jones JL et al. A Mediterranean-style, low–glycemic-load diet decreases atherogenic lipoproteins and reduces lipoprotein (a) and oxidized low-density lipoprotein in women with metabolic syndrome. Metabolism (2011), doi:10.1016/j.metabol.2011.07.013.
Jönsson T et al. A paleolithic diet is more satiating per calorie than a mediterranean-like diet in individuals with ischemic heart disease. Nutr Metab (Lond). 2010;7:85.
Rizzo NS et al. Vegetarian dietary patterns are associated with a lower risk of metabolic syndrome. Diabetes Care. 2011;34:1225-1227.
Gardner CD et al. Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A TO Z Weight Loss Study: a randomized trial. JAMA. 2007;297(9):969-77.
McKeown NM et al. Carbohydrate nutrition, insulin resistance, and the prevalence of the metabolic syndrome in the Framingham Offspring Cohort. Diabetes Care 2004;27:538-546.
Strazzullo P et al. Altered renal sodium handling in men with abdominal adiposity: a link to hypertension. J Hypertens. 2001;19:2157-64.
DiPetrillo K et al. Tumor necrosis factor induces sodium retention in diabetic rats through sequential effects on distal tubule cells. Kidney Int. 2004;65:1676-1683.
Haynes WG. Role of leptin in obesity-related hypertension. Exp Physiol. 2005;90:683-688.
Skott P et al. Effect of insulin on renal sodium handling in hyperinsulinemic type II (noninsulin-dependent) diabetic patients with peripheral insulin resistance. Diabetologia. 1991;34:275-281.
Cook NR et al. Long term effects of dietary sodium reduction on cardiovascular disease outcomes: observational follow-up of the trials of hypertension prevention (TOHP). BMJ. 2007;334(7599):885-8.
Alkerwi A et al. Alcohol consumption and the prevalence of metabolic syndrome: a meta-analysis of observational studies. Atherosclerosis. 2009;204(2):624-35.
Qin B et al. Cinnamon: potential role in the prevention of insulin resistance, metabolic syndrome, and type 2 diabetes. J Diabetes Sci Technol. 2010;4(3):685-693.
Lu Z et al. Hypoglycemic activities of A- and B-type procyanidin oligomer-rich extracts from different Cinnamon barks. Phytomedicine 2011;18:298-302.
Anderson RA. Chromium and polyphenols from cinnamon improve insulin sensitivity. Proceedings of the Nutrition Society 2008;67:48–53.
Hlebowicz J et al. Effects of 1 and 3 g cinnamon on gastric emptying, satiety, and postprandial blood glucose, insulin, glucose-dependent insulinotropic polypeptide, glucagonlike peptide 1, and ghrelin concentrations in healthy subjects. Am J Clin Nutr. 2009;89:815-821.
Ziegenfuss TN et al. Effects of a water-soluble cinnamon extract on body composition and features of the metabolic syndrome in pre-diabetic men and women. J Int Soc Sports Nutr 2006;3:45-53.
Davis PA et al. Cinnamon intake lowers fasting blood glucose: meta-analysis. J Med Food 2011;14(9):884-889.
Matsuda T et al. Silymarin protects pancreatic β-cells against cytokine-mediated toxicity: implication of c-Jun NH2-terminal kinase and Janus kinase/signal transducer and activator of transcription pathways. Endocrinology 2005;146(1):175-185.
Manna SK et al. Silymarin suppresses TNF-induced activation of NF-kappa B, c-Jun N-terminal kinase, and apoptosis. J Immunol. 1999;163:6800-09.
Permana PA et al. Macrophage-secreted factors induce adipocyte inflammation and insulin resistance. Biochem Biophys Res Commun. 2006;341:507-514.
Huseini HF et al. The efficacy of Silybum marianum (L.) Gaertn. (silymarin) in the treatment of type II diabetes: a randomized, double-blind, placebo-controlled, clinical trial. Phytother Res. 2006;20:1036-39.
Jain SK. Vitamin B6 (pyridoxamine) supplementation and complications of diabetes. Metabolism Clinical and Experimental 2007;56:168-171.
Bjorck J et al. Associations between serum insulin and homocysteine in a Swedish population-a potential link between the metabolic syndrome and hyperhomocysteinemia: the Skaraborg project. Metabolism. 2006;55:1007-13.
Setola E et al. Insulin resistance and endothelial function are improved after folate and vitamin B12 therapy in patients with metabolic syndrome: relationship between homocysteine levels and hyperinsulinemia. Eur J Endocrinol. 2004;151:483-489.
Meyers CD et al. Niacin therapy in atherosclerosis. Curr Opin Lipidol. 2004;15:659-665.
Meyers CD et al. Management of the metabolic syndrome – nicotinic acid. Endocrinol Metab Clin North Am. 2004;33:557-575.
Shepherd J et al. Nicotinic acid in the management of dyslipidaemia associated with diabetes and metabolic syndrome: a position paper developed by a European Consensus Panel. Curr Med Res Opin. 2005;21:665-682.
Ford ES et al. The metabolic syndrome and antioxidant concentrations. Findings from the third national health and nutrition examination survey. Diabetes 2003;52:2346-2352.
Evans JL et al. The molecular basis for oxidative stressinduced insulin resistance. Antioxid Redox Signal. 2005;7:1040-1052.
Pinelli NR et al. Serum 25-hydroxy vitamin D and insulin resistance, metabolic syndrome, and glucose intolerance among arab americans. Diabetes Care 2010;33:1373-1375.
Chiu KC et al. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction. Am J Clin Nutr. 2004;79:820-825.
Ford ES et al. Concentrations of serum vitamin D and metabolic syndrome among US adults. Diabetes Care 2005;28:1228-1230.
Barbagallo M et al. Magnesium metabolism in type 2 diabetes mellitus, metabolic syndrome and insulin resistance. Arch Biochem Biophys. 2007;458(1):40-7.
Abete I et al. Obesity and metabolic syndrome: potential benefit from specific nutritional components. Nutr Metab Cardiovasc Dis. 2011;21(Suppl 2):B1-15.
Evangelopoulos A et al. An inverse relationship between cumulating components of the metabolic syndrome and serum magnesium levels. Nutr Res. 2008;28(10):659-63.
Rodriguez-Moran M et al. Oral magnesium supplementation improves insulin sensitivity and metabolic control in type 2 diabetic subjects: a randomized double-blind controlled trial. Diabetes Care 2003;26:1147-52.
Song Y et al. Magnesium intake, C-reactive protein, and the prevalence of metabolic syndrome in middle-aged and older U.S. women. Diabetes Care 2005;28:1438-44.
Mooren FC et al. Oral magnesium supplementation reduces insulin resistance in non-diabetic subjects – a double-blind, placebo-controlled, randomized trial. Diabetes Obes Metab. 2011;13(3):281-4.
Anderson RA. Chromium in the prevention and control of diabetes. Diabetes Metab. 2000;26:22-27.
Lee NA et al. Beneficial effect of chromium supplementation on serum triglyceride levels in NIDDM. Diabetes Care 1994;17:1449-1452.
Bahijiri SM et al. The effects of inorganic chromium and brewer’s yeast supplementation on glucose tolerance, serum lipids and drug dosage in individuals with type 2 diabetes. Saudi Med J. 2000;21:831-837.
Marreiro DN et al. Role of zinc in insulin resistance. Arq Bras Endocrinol. Metabol. 2004;48:234-39.
Zulet MA et al. Dietary selenium intake is negatively associated with serum sialic acid and metabolic syndrome features in healthy young adults. Nutr Res. 2009;29:41-48.
Bo S et al. Gestational hyperglycemia, zinc, selenium, and antioxidant vitamins. Nutrition 2005;21:186-191.
Chatterjee R et al. Serum and dietary potassium and risk of incident type 2 diabetes mellitus. Arch Intern Med. 2010;170(19):1745-1751.
Cicero AF et al. Different effect of psyllium and guar dietary supplementation on blood pressure control in hypertensive overweight patients: a six-month, randomized clinical trial. Clin Exp Hypertens. 2007;29:383-394.
A Comparative Evaluation of Ispaghula Husk (Dietary Fiber) and Simvastatin in Hyperlipidemic Indian Patients. Indian Heart Journal 2002;54(5).
Carpentier YA et al. N-3 Fatty acids and the metabolic syndrome. Am J Clin Nutr. 2006;83(Suppl):1499S–504S.
Haag M et al. Dietary fats, fatty acids and insulin resistance: short review of a multifaceted connection. Med Sci Monit. 2005;11:359-367.
Warensjo E et al. Factor analysis of fatty acids in serum lipids as a measure of dietary fat quality in relation to the metabolic syndrome in men. Am J Clin Nutr. 2006;84:442-448.
Delarue J et al. N-3 long chain polyunsaturated fatty acids: a nutritional tool to prevent insulin resistance associated to type 2 diabetes and obesity? Reprod Nutr Dev. 2004;44:289-99.
Mori TA. Omega-3 fatty acids and hypertension in humans. Clin Exp Pharmacol Physiol. 2006;33:842-46.
Mishra A et al. Oxidized omega-3 fatty acids inhibit NF-kappaB activation via a PPARalpha-dependent pathway. Arterioscler Thromb Vasc Biol. 2004;24:1621-27.
Yashodhara BM et al. Omega-3 fatty acids: a comprehensive review of their role in health and disease. Postgrad Med J. 2009;85:84–90.
Klik hier voor advies of voor het maken van een afspraak voor een gratis en vrijblijvend consult.

